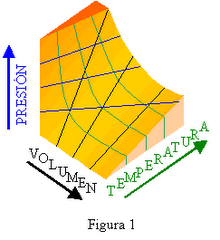
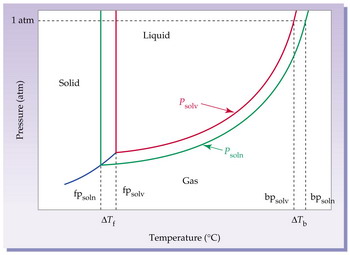
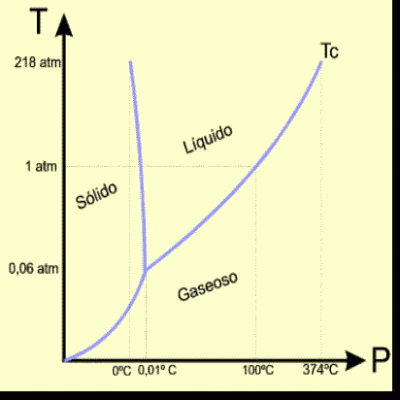
Introducción a la Primera Ley...
Buenos días!!!
Pido disculpas por no haber podido asignar la actividad virtual hasta hoy, es que lamentablemente se me complicó el acceso a Internet... Les recuerdo que se está implementando el Google Site, pronto les daré más detalles al respecto, estoy esperando respuestas de la Coordinación de Informática (la “CLIET”)…
En la búsqueda de unas tablas termodinámicas adecuadas para el Refrigerante 134a, descubrí esta página Web: http://dcb.fi-c.unam.mx/CoordinacionesAcademicas/FisicaQuimica/Termodinamica/descargass.htm, de la Universidad Nacional Autónoma de México, que contiene algunos programas que pueden descargar y les permitirá obtener las propiedades termodinámicas de muchas sustancias, incluyendo al esquivo R134a… muy interesante… y más aún http://librosdeiq.wordpress.com/2008/06/05/tpx-thermodynamic-properties-for-excel-version-en-espanol/, donde se consigue un “Add-on” para Excel que permite calcular propiedades termodinámicas…
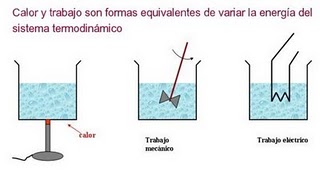
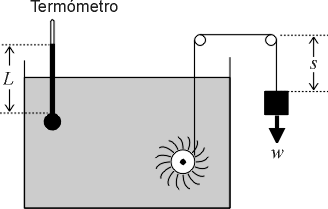
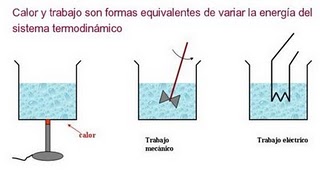
Como estamos en las horas posteriores al primer Parcial, y ya estamos entrando al segundo corte, les dejo el tema de conversación de esta semana, que como sabemos, es la Primera Ley de la Termodinámica, o la versión "mesoscópica" (ni microscópica ni macroscópica) del "Principio de Conservación de la Energía"...
En Wikipedia (http://es.wikipedia.org/wiki/Primera_ley_de_la_termodin%C3%A1mica) y en http://soko.com.ar/Fisica/Termodinamica.htm aparecen comentarios bien interesantes (académicamente) sobre este aspecto, y en http://www.lorem-ipsum.es/blogs/hal9000/?p=43 se presenta un artículo sobre "El Juego de la Termodinámica", que explica, somera y juguetonamente las Tres Leyes de la Termodinámica. Les recomiendo encarecidamente su consulta y lectura, de hecho me recuerdan al video...
Sus comentarios de esta semana, estarán relacionados a ¿cómo interpreta cada uno de ustedes el enunciado de la Primera Ley de la Termodinámica, en la cotidianidad de su vida diaria?...
Saludos!!!
 )
)