Primera Actividad del Segundo Corte...
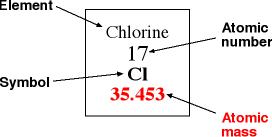
Buenas Noches!!!
Ya les tengo "casi" listas las notas del primer corte, lamentablemente he tenido algunos problemas logísticos para traérselas (no tengo tinta en mi impresora ni capital para imprimir por fuera...;P)... Pero estamos pendiente con eso, seguramente para el día de Laboratorio me las estarán firmando...
Esta semana arrancamos en forma el segundo corte, y para ello es necesario que revisemos los conceptos que les solicité en clase, acerca del Número de Avogadro (http://es.wikipedia.org/wiki/N%C3%BAmero_de_Avogadro, donde aparecen incluso unos ejemplos interesantes y que vamos a considerar en clase, cortesía de Wikipedia.org, y http://encina.pntic.mec.es/~jsaf0002/p42.htm, con una explicación bien interesante del uso de esta unidad), y las masas atómica y molecular (tamién llamados "pesos", en http://es.wikipedia.org/wiki/Masa_at%C3%B3mica, otra vez Wikipedia.org, y en http://www.eis.uva.es/~qgintro/esteq/tutorial-01.html, un tutorial muy interesante sobre nuestro objetivo a tratar, vale la pena curiosearlo detenidamente...)
Para la actividad virtual, voy a pedirles que comenten sobre el método de cálculo de las masas moleculares de los compuestos, partiendo de la cantidad de átomos constituyentes. ¿Cómo se hace? ¿qué debe tomarse en cuenta? ¿cómo se identificarían esos compuestos, es decir, qué nombre les daríamos?
Saludos!!!
45 comentarios
JUAN PABON CI: 84.034.778 INGENIERIA PETROQUIMICA SECCION: I 005 -
Ejemplo:
2 Fe + O2 → 2 FeO
Consultando una tabla periódica podemos ver que la masa atómica del Fe es 56 uma y la masa molecular del O2 es 32 uma, mientras que la masa del FeO es 56 + 16 = 72 uma. Al observar la reacción ajustada, vemos que la relación de masas que intervienen en la reacción es:
2 masa Fe + masa O2 → 2 masa FeO
Es decir:
2 56 + 32 → 2 72
La misma relación de masas atómicas o moleculares se cumple tanto en unidades de masa atómica como en gramos o en kilogramos. Por tanto, se puede afirmar que 112 g de hierro reaccionan con 32 g de oxígeno atmosférico para producir 144 g de FeO.
Procedimiento de cálculo con reacciones químicas
1.- Ajusta la reacción química.
2.- Determina las masas atómicas o moleculares de las sustancias que intervienen.
3.- Multiplica dichas masas por los correspondientes números enteros que has escrito antes para ajustar la reacción.
4.- Los valores obtenidos, expresados en cualquier unidad de masa, indican las cantidades de reactivo y de producto que intervienen en la reacción.La masa isotópica relativa es la masa relativa de un isótopo dado (más específica, cualquier núclido solo), escalado con el carbono-12 como exactamente 12. y teoría atómica Dalton establece que los átomos de los distintos elementos tienen masas diferentes.
paolix oropeza Ci:20055094 ing civil I-003 -
La masa molecular se determina sumando las masas at¨®micas relativas de los elementos cuyos ¨¢tomos constituyen una mol¨¦cula de dicha sustancia. A pesar de que se sigue diciendo popularmente peso molecular, el t¨¦rmino correcto es masa molecular. La masa molar de una sustancia coincide num¨¦ricamente con la masa molecular, aunque son cosas distintas.
La formula para calcular es: % elemento X= [(n¨²m. ¨¢tomos de X)¡¤Ar(X)/Mr]¡¤100%
La masa molecular se calcula sumando las masas at¨®micas de los elementos que componen la mol¨¦cula. As¨ª, en el caso de la mol¨¦cula de agua, H2O, su masa molecular ser¨ªa:
(masa at¨®mica del H: 1,0079, masa at¨®mica del O: 15,99994)
Se multiplica por 2, ya que la mol¨¦cula de agua contiene 2 ¨¢tomos de hidr¨®geno (H).
El peso molecular medio por part¨ªcula resulta del inverso la suma de los inversos del peso molecular por ion con el peso molecular por electr¨®n. En el caso del peso medio por ion simboliza el peso medio de un ion de la mezcla mientras que en el peso medio por electr¨®n es el peso molecular por cada electr¨®n de la mezcla. Se calculan de la siguiente manera:
Sea una especie qu¨ªmica j. Se tratar¨¢ de hallar, en primer lugar, el n¨²mero de part¨ªculas de cada especie por unidad de volumen.
Para hallar el n¨²mero de iones por unidad de volumen de cada especie se multiplicar¨¢ la densidad por la fracci¨®n de masa para obtener solo la densidad de esa sustancia concreta. Luego se dividir¨¢ por el n¨²mero m¨¢sico dado en (uma o g/mol). Solo bastar¨¢ multiplicar por el n¨²mero de Avogadro para obtener el n¨²mero de iones. Para el caso de los electrones har¨¢ falta un paso m¨¢s ya que todos los iones salvo los de hidr¨®geno poseen m¨¢s de un electr¨®n en su corteza. Concretamente habr¨¢ que multiplicar el resultado por el n¨²mero at¨®mico que no es otra cosa que el n¨²mero de protones del ion. Ese valor dicta el n¨²mero de electrones que se pueden desprender de ¨¦l como m¨¢ximo. Dichos valores se obtienen como sigue:
N¨²mero de iones:
N¨²mero de electrones:
Donde NA es el n¨²mero de Avogadro, ¦Ñ la densidad de la estrella, Xj la fracci¨®n de masa, Zj el n¨²mero at¨®mico y Aj el n¨²mero m¨¢sico.
pedro lopez c.i 22.518.611 i005 petroquimica -
De Wikipedia, la enciclopedia libre
Saltar a navegación, búsqueda
La masa molecular relativa es un número que indica cuántas veces mayor es la masa de una molécula de una sustancia con respecto a la unidad de masa atómica. Se determina sumando las masas atómicas relativas de los elementos cuyos átomos constituyen una molécula de dicha sustancia.
La formula para calcular es: % elemento X= [(núm. átomos de X)·Ar(X)/Mr]·100%
La masa molecular se calcula sumando las masas atómicas de los elementos que componen la molécula
En el caso de la molécula de agua, H2O, su masa molecular sería:
(masa atómica del H: 1,0079, masa atómica del O: 15,99994)
(Se multiplica por 2, ya que ésa es la cantidad de veces que el elemento H está presente en la molécula.)
ej: hierro:4d
La masa molar de una sustancia coincide numéricamente con la masa molecular, aunque son cosas distintas.
A pesar de que se sigue diciendo popularmente peso molecular, el término correcto es masa molecular.
Si se necesita la masa molecular de varios componentes, se multiplican por separado los átomos de cada componentes y se multiplican por la masa atómica. Luego se suman los dos. Vamos a determinar, por ejemplo, la masa molecular del componente C3H8:
Elemento = Átomos * Peso atómico
C= 3 * 12 = 36
H= 8 * 1 = 8
Masa molecular= 44 g/mol
jose paredes I005 petroquimica -
El cálculo del peso molecular es sencillo. Tomamos la fórmula molecular de un compuesto, tomamos los pesos atómicos de los elementos que lo componen y multiplicamos cada peso atómico por el subíndice que corresponde al elemento según la fórmula molecular.
Ejm: Calcule el peso o masa molecular del H2SO4 (Acido Sulfurico)
entonces: 2H: 2*1=2
S: 32*1=32
4O: 4*16=64
todo esto es igual a: 98g/mol que es el peso molecular del acido sulfurico.
el término "peso molecular" debido a su uso extendido, el cientificamente correcto es "masa molecular". El peso es una fuerza, es decir una cantidad vectorial que posee módulo, dirección y sentido y depende del campo gravitacional en el que se encuentre inmerso. La masa, en cambio es un escalar y es independiente del campo gravitacional. Si la misma se expresa sin unidades se denomina "masa molecular relativa", mientras que si la unidad es "g/mol" recibe el nombre de "masa molar".
La masa molecular relativa es un número que indica cuántas veces mayor es la masa de una molécula de una sustancia con respecto a la unidad de masa atómica. Se determina sumando las masas atómicas relativas de los elementos cuyos átomos constituyen una molécula de dicha sustancia.
La formula para calcular es: % elemento X= [(núm. átomos de X)·Ar(X)/Mr]·100%
La masa molecular se calcula sumando las masas atómicas de los elementos que componen la molécula
ana gallardo petroquimica i005 -
buenos dias ESTA ES LA RESPUETA DE ACTIVIDAD
La masa molecular relativa es un número que indica cuántas veces mayor es la masa de una molécula de una sustancia con respecto a la unidad de masa atómica. Se determina sumando las masas atómicas relativas de los elementos cuyos átomos constituyen una molécula de dicha sustancia.
La formula para calcular es: % elemento X= [(núm. átomos de X)·Ar(X)/Mr]·100%
La masa molecular se calcula sumando las masas atómicas de los elementos que componen la molécula
En el caso de la molécula de agua, H2O, su masa molecular sería:
(masa atómica del H: 1,0079, masa atómica del O: 15,99994)
(Se multiplica por 2, ya que ésa es la cantidad de veces que el elemento H está presente en la molécula.)
ej: hierro:4d
La masa molar de una sustancia coincide numéricamente con la masa molecular, aunque son cosas distintas.
A pesar de que se sigue diciendo popularmente peso molecular, el término correcto es masa molecular.
Si se necesita la masa molecular de varios componentes, se multiplican por separado los átomos de cada componentes y se multiplican por la masa atómica. Luego se suman los dos. Vamos a determinar, por ejemplo, la masa molecular del componente C3H8:
Elemento = Átomos * Peso atómico
C= 3 * 12 = 36
H= 8 * 1 = 8
Rosmar Silva seccion 003I civil 16400961 -
Si se conoce la fórmula molecular de una molécula, su peso molecular se calcula a partir de los pesos atómicos de los elementos que la constituyen. Así para una molécula AaBbCc .Nn (las minúsculas son subíndices), el peso molecular será a*(peso atómico A) + b*(peso atómico B) + c*(peso atómico C) + + n*(peso atómico N).
Este es un mero ejercicio académico y se usa para averiguar si la fórmula molecular propuesta es la correcta por comparación del resultado con el peso molecular obtenido experimentalmente.
Existen diversos métodos para medir pesos moleculares en función del tipo de sustancia. Te comentaré algunos.
-Determinación pesos moleculares por crioscopia:
El peso molecular de un soluto se determina a partir del descenso en la temperatura de congelación de un disolvente que se produce al disolver un soluto en él.
En general, cuando un soluto (s) se disuelve en un disolvente líquido (d), el punto de congelación de éste disminuye. Este fenómeno es una de las propiedades coligativas, es decir, una propiedad cuya magnitud depende primariamente del número de moles del soluto disuelto con relación a una determinada cantidad de disolvente.
Supongamos una pequeña cantidad de soluto disuelta en un disolvente, que se encuentra en equilibrio con el disolvente sólido. El descenso crioscópico, DTc, se define como:
Tc = Kc.* ms.=Kc.*PS/(Pd*ms.)
Donde Kc es la constante crioscopia del disolvente
ms es la modalidad del soluto.
Ms es el peso molecular del soluto
Así, si en un experimento se mide Tc para diferentes disoluciones que contienen diferentes pesos Ps de soluto disueltos siempre en el mismo peso Pd del disolvente se obtendrá una recta al representar Tc frente a Ps de cuya pendiente se puede calcular el peso molecular Ms del soluto.
-Determinación pesos moleculares por ebulloscopio:
Este método es similar al anterior, pero midiendo el aumento en la temperatura de ebullición de un disolvente al disolver diferentes cantidades de un soluto.
Tb = Kb*ms
También se puede obtener el peso molecular de un soluto a partir de velocidades de difusión por ósmosis, velocidad de sedimentación, etc. Los resultados más exactos los proporciona la espectroscopia de masas.
Para gases se puede usar la ecuación de estado del gas ideal, o cualquier otra ecuación de estado de los gases.
P*V= n*R*T=(m/PM)*R*T
PM= densidad* R*T/P
Así midiendo la densidad de un gas, podemos determinar su peso molecular.
Esto también es útil para líquidos. Se lleva a ebullición a un líquido y si mide el volumen que se ha evaporado, pudiendo así obtener su densidad y después su peso molecular.
Para proteínas y polímeros existen también diversas técnicas cromatográficas, que van desde la cromatografía por exclusión de gel, en el que los polímeros se separan en función de su tamaño (directamente proporcional al peso molecular) hasta técnicas de electroforesis. Los métodos clásicos implicaban reacciones catalíticas para romper la molécula en los elementos constituyentes y luego los identificaban con marchas analíticas.
Por ejemplo, para moléculas orgánicas se sometían a oxidación o combustión, luego se recogían los gases, CO2 y H20 se determinaba la cantidad (por ejemplo, determinando el aumento de peso producido en filtros selectivos de ambas sustancias) y a partir de ahí se determina la cantidad de C, H y O presente en la sustancia.
Para determinar la fórmula empírica, hemos de seguir los siguientes pasos:
1º) tomamos una masa determinada del compuesto;
2º) determinamos las masas de los elementos químicos que forman el compuesto;
3º) calculamos el número de moles de cada elemento químico;
4º) obtenemos la relación, en números enteros, entre los elementos que constituyen el compuesto. Para esto se divide por el número de moles más pequeño. Los números obtenidos serán los subíndices de la formula empírica.
Actualmente se utilizan métodos espectrofotométricos y cromatografitos. Para identificar que elementos están formando parte de una molécula se usa la espectrofotometría infrarroja, Raman y alguna más.
A partir del espectro se identifican las distintas bandads, que corresponden a átomos o grupos de átomos.
La espectroscopia de masas ha supuesto un gran avance, ya que permite la cuantificación, no solo la identificación. Pero es una técnica muy complicada y difícil de explicar. Te diré que se basa en la descomposición de una molécula en los átomos que la forman, estos átomos se separan en función de su relación carga-masa atómica, lo que permite su identificación.
LA determinación de la composición elemental de una molécula no es una tarea sencilla y muchas veces requiere del uso de varias técnicas, primero para identificar que elementos hay (usando espectroscopia infrarroja, raman, resonancia magnética nuclear) y luego para cuantificar el nº de átomos (espectrometría de masas).
katherine velasquez -
y su formaula para saber cuantos nos va a quedar6,022045 × 1023. esta es una de las formulas mas utilizadas en le peso atomico y enh le calculo de las masa moleculares
jose paredes i005 petroquimica II -
debemos tomar en cuenta la masa de cada de los elementos que intervienen en el compuesto.
los gramos del compuesto en si ejm. 250g de FeCl3 .
para poder determinar la masa total del conpuesto se debe multiplicar x 1mol los gramos de la solucion y luego dividirlo por la masa del conpuesto para saber los moles el esa reaccion.
LA MASA DEL ELEMENTO es su masa x el numero de veces q se encuentra en el compuesto.
luego para calcular la cantidad de atomos en la reaccion se realiza lo siguiente se multiplica la masa total mol x el numero de avogadro 6,022045 × 1023. y les dara la camtidad de moleculas de ese compuesto.
estos conpuestos de le dan nombre de acuerdo con su nomenclatura.. se son reacciones con metales y oxigeno se las llama oxidos basicos y si son con no metales y oxigeno se llaman acidos axacidos.
y si son con no metales y hidrogene son los hidruros.. ejemplo oxido ferroso o ferrico
acido sulfurico
cloruro de hidrogeno( acido clorhidrido)entre otros...
katherine velasquez -
Este metodo se realiza en muchos enlaces quimicos de varios elementos, y asi podems darnos cuenta de la manera en que se distribuyen a la hora del enlace
Para calcularla debemos saber las masas atómicas de cada uno de los elementos que intervienen en el compuesto.
paolix oropeza CI:20055094 ing civil I-003 II semestre -
La formula para calcular es: % elemento X= [(núm. átomos de X)·Ar(X)/Mr]·100%
La masa molecular se calcula sumando las masas atómicas de los elementos que componen la molécula
En el caso de la molécula de agua, H2O, su masa molecular sería:
(masa atómica del H: 1,0079, masa atómica del O: 15,99994
La masa atómica (ma) es la masa de un átomo, más frecuentemente expresada en unidades de masa atómica unificada.[1] La masa atómica puede ser considerada como la masa total de protones, neutrones y electrones en un solo átomo (cuando el átomo no tiene movimiento). La masa atómica es algunas veces usada incorrectamente como un sinónimo de masa atómica relativa, masa atómica media y peso atómico; estosEl peso atómico estándar se refiere a la media de las masas atómicas relativas de un elemento en el medio local de la corteza terrestre y la atmósfera terrestre, como está determinado por la Commission on Atomic Weights and Isotopic Abundances (Comisión de Pesos Atómicos y Abundancias Isotópicas) de la IUPAC.[2] Estos valores son los que están incluidos en una tabla periódica estándar, y es lo que es más usado para los cálculos ordinarios últimos difieren sutilmente de la masa atómica.
reina gonzalez II semestre petroquimica -
La masa molecular es la suma de las masas atómicas (en 'uma' o simplemente 'u') en una molécula. En algunos textos todavía se denomina como 'peso molecular' a la 'masa molecular'.
Para calcularla debemos saber las masas atómicas de cada uno de los elementos que intervienen en el compuesto.
Empezaremos por uno de los lados de la fórmula, por ejemplo
Multiplicaremos el subíndice del elemento (cuando no existe se asume que es 1) por la masa atómica del mismo.
Procederemos de la misma forma con todos los elementos.
Sumaremos los resultados de todas las multiplicaciones y de esta forma tendremos la masa molecular expresada en unidades de masa atómica ('uma' o 'u').
Ejemplo de cálculo de masas moleculares
Si la fórmula tiene un paréntesis, multiplicaremos cada uno de los subíndices que se encuentren dentro del paréntesis por el número que viene como subíndice del paréntesis.
Nombres que se le pueden dar a los compuestos:
Los principales compuestos químicos que existen en la actualidad son:
Óxidos básicos, que están formados por un metal y oxígeno.ejemplos, el óxido plúmbico,óxido de litio,.
Óxidos ácidos, formados por un no metal y oxígeno. ejemplos, óxido hipocloroso,óxido selenioso,.
Hidruros, que pueden ser tanto metálicos como no metálicos. Están compuestos por un elemento e hidrógeno.ejemplos, hidruro de aluminio, hidruro de sodio,.
Hidrácidos, son hidruros no metálicos que, cuando se disuelven en agua, adquieren carácter ácido. Por ejemplo, el ácido iodhídrico,.
Hidróxidos, compuestos formados por la reacción entre un óxido básico y el agua, que se caracterizan por presentar el grupo oxidrilo (OH). Por ejemplo, el hidróxido de sodio, o sosa cáustica.
Oxoácidos, compuestos obtenidos por la reacción de un óxido ácido y agua. Sus moléculas están formadas por hidrógeno, un no metal y oxígeno. Por ejemplo, ácido clórico.
Sales binarias, compuestos formados por un hidrácido más un hidróxido. Por ejemplo, el cloruro de sodio.
Oxisales, formadas por la reacción de un oxoácido y un hidróxido, como por ejemplo el hipoclorito de sodio.
Pedro Sanchez, C.I. 21.238.868, Ing. Petroquimica I-005, 2º Semestre. -
Este metodo se realiza en muchos enlaces quimicos de varios elementos, y asi podems darnos cuenta de la manera en que se distribuyen a la hora del enlace. por ejemplo si poseemos un enlace (Fe2o3) y queremos hallar su masa molecular debemos sguir los siguientes pasos:
Nº de atomos:
Fe= 2
O= 3
Peso atomico:
Fe= 55,84
O= 15,99
Y sustituimos esos datos en la siguiente ecuacion:
Elemento= Atomos * Peso
atomico
Sustituyendo:
Fe= 2 * 55,84 = 111,68
O= 3 * 15,99 = 47,97
Y para su masa molecular:
Mm(Fe2O3) = MmO + MmFe
Mm(Fe2O3) = 159,65 g/mol
jonathan Quiñones -
C.I:19.479.058
SECCION:I-005 PETROQUIMICA
La determinación del peso molecular de los compuestos de un elemento dado permite hallar fácilmente su peso atómico. Puesto que los átomos son indivisibles, en una molécula hay, necesariamente, un número entero de átomos de cada clase y, casi siempre, un número entero sencillo. Si se determina el peso molar de los compuestos de. un elemento y, por análisis, se averigua la cantidad de elemento que existe en dichos pesos molares, las cantidades halladas son múltiplos sencillos del peso atómico gramo correspondiente (peso atómico expresado en gramos) y, por consiguiente, este peso atómico será, muy probablemente, el máximo común divisor de todas aquellas cantidades.
Si se necesita la masa molecular de varios componentes, se multiplican por separado los átomos de cada componentes y se multiplican por la masa atómica. Luego se suman los dos. Vamos a determinar, por ejemplo, la masa molecular del componente C3H8:
Elemento = Átomos * Peso atómico
C= 3 * 12 = 36
H= 8 * 1 = 8
Masa molecular= 44 g/mol
rubenangel borges -
debemos tomar en cuenta la masa de cada de los elementos que intervienen en el compuesto.
los gramos del compuesto en si ejm. 250g de FeCl3 .
para poder determinar la masa total del conpuesto se debe multiplicar x 1mol los gramos de la solucion y luego dividirlo por la masa del conpuesto para saber los moles el esa reaccion.
LA MASA DEL ELEMENTO es su masa x el numero de veces q se encuentra en el compuesto.
luego para calcular la cantidad de atomos en la reaccion se realiza lo siguiente se multiplica la masa total mol x el numero de avogadro 6,022045 × 1023. y les dara la camtidad de moleculas de ese compuesto.
estos conpuestos de le dan nombre de acuerdo con su nomenclatura.. se son reacciones con metales y oxigeno se las llama oxidos basicos y si son con no metales y oxigeno se llaman acidos axacidos.
y si son con no metales y hidrogene son los hidruros.. ejemplo oxido ferroso o ferrico
acido sulfurico
cloruro de hidrogeno( acido clorhidrido).. etc.
rubenangel borges
20.385.978
I:005 II
monica portela I003D Ing Civil -
La masa molecular es la suma de las masas atómicas (en 'uma' o simplemente 'u') en una molécula. En algunos textos todavía se denomina como 'peso molecular' a la 'masa molecular'.
1.
Para calcularla debemos saber las masas atómicas de cada uno de los elementos que intervienen en el compuesto.
2.
Empezaremos por uno de los lados de la fórmula, por ejemplo el izquierdo.
3.
Multiplicaremos el subíndice del elemento (cuando no existe se asume que es 1) por la masa atómica del mismo.
4.
Procederemos de la misma forma con todos los elementos.
5.
Sumaremos los resultados de todas las multiplicaciones y de esta forma tendremos la masa molecular expresada en unidades de masa atómica ('uma' o 'u').
Ejemplo de cálculo de masas moleculares en formato flash (puede tardar un poco en abrirse)
Otros ejemplos:
Si la fórmula tiene un paréntesis, multiplicaremos cada uno de los subíndices que se encuentren dentro del paréntesis por el número que viene como subíndice del paréntesis.
Ir a la parte superior de la página
Composición porcentual a partir de la fórmula.
El porcentaje en peso de cada uno de los elementos en un compuesto siempre debe ser el mismo, independientemente de la cantidad de compuesto que tengamos; es decir, si un compuesto orgánico tiene un 40% en peso del elemento carbono (C), lo tendrá tengamos un gramo o una tonelada de dicho compuesto: el 40% de esa cantidad será carbono.
¿Cómo se calcula la composición porcentual? Para contestar la pregunta utilizaremos un ejemplo. Calculemos el porcentaje en peso de los elementos que hay en el SO3 (MS = 32 u ; MO = 16 u).
1.
Calcularemos la masa molecular del compuesto:
Masa molecular del trióxido de azufre
2.
Calculamos el número de unidades de masa atómica del primer elemento de la fórmula (masa atómica multiplicada por el número de átomos que hay de dicho elemento en la fórmula. Dicho número lo dividimos por la masa molecular (masa de todo el compuesto en unidades de masa atómica) y el resultado se multiplica por cien. Fíjate que el cociente debe ser inferior a la unidad dado que la masa de cada elemento en la fórmula debe ser inferior al total (hay otros elementos). Al multiplicar un cociente inferior a la unidad por cien el resultado será inferior a cien. Si es necesario se suele redondear el porcentaje a un decimal.
Cálculo del porcentaje en peso del azufre en el trióxido de azufre.
donde nS es el número de átomos de S (azufre) que hay en el compuesto.
3.
Repetimos el proceso con cada uno de los otros elementos.
Cálculo del porcentaje en peso del oxígeno en el trióxido de azufre.
donde nO es el número de átomos de O (oxígeno) que hay en el compuesto.
4.
Para comprobar si los cálculos son correctos debemos sumar todos los porcentajes. La suma debe ser el 100% (admitimos ±0,1% por errores de decimales al dividir). En nuestro ejemplo, si sumamos los dos porcentajes nos da el 100%.
Importante. Conviene calcular todos los porcentajes, incluido el último; o sea, no calcules el último restando a 100% la suma de los otros. ¿Por qué? Para comprobar si cometes errores, si lo haces restando nuca sabrás si has cometido errores al calcular alguno de los porcentajes dado que la suma siempre saldría el cien por cien.
Ir a la parte superior de la página
Determinación de la fórmula empírica.
Para determinar la fórmula empírica debemos conocer el porcentaje en peso de cada elemento en el compuesto y las masas atómicas de cada uno de ellos. Por ejemplo, supongamos que tenemos 40,00% de C, 6,67% de H y 53,33% de O. Las masas atómicas son MC=12u, MH=1u, MO=16u.
Seguiremos los siguientes pasos:
1.
Consideramos 100 g de compuesto: el porcentaje de cada uno serán los gramos de cada elemento que hay en 100 g de compuesto. Siguiendo el ejemplo, tendremos 40,00 g de C, 6,67 g de H y 53,33 g de O.
2.
Dividimos cada masa por la masa atómica del elemento correspondiente:
*
C: 40,00 / 12 = 3,33
*
H: 6,67 / 1 = 6,67
*
O: 53,33 / 16 = 3,33
3.
Ahora dividimos cada uno de los resultados anteriores por el más pequeño de ellos, en este caso por 3,33:
*
C: 3,33 / 3,33 = 1
*
H: 6,67 / 3,33 = 2
*
O: 3,33 / 3,33 = 1
4.
El resultado debe ser un número entero, los números enteros más pequeños, y la fórmula empírica sería C1H2O1, quitando los unos quedaría CH2O como fórmula empírica.
Ir a la parte superior de la página
Determinación de la fórmula molecular.
Para conocer la fórmula molecular, debemos tener los mismos datos de partida que para la fórmula empírica (porcentajes y masas atómica) y, además, la masa molecular del compuesto (en nuestro ejemplo sería 180 u).
Seguiríamos los mismos cuatro pasos del caso anterior para determinar la fórmula empírica y continuaríamos de la siguiente forma:
5.
Calculamos la masa molecular con la fórmula empírica. En nuestro ejemplo sería sobre el compuesto de fórmula empírica CH2O:
6.
Ahora dividimos la masa molecular real que nos han dado, entre la masa calculada con la fórmula empírica:
*
masa molecular / masa fórmula empírica = 180 / 30 = 6
7.
El resultado nos indica el número de veces que la fórmula molecular será la fórmula empírica. Para escribir la fórmula molecular multiplicaremos cada subíndice de la fórmula empírica por el número obtenido de la división:
C1·6 H2·6 O1·6 > C6H12O6
Por tanto, la fórmula molecular será en nuestro caso C6H12O6
darlis giran I003D Ing Civil 2 semestre -
Masa atómicaLa masa atómica también suele recibir el nombre de peso atómico, aunque esta denominación es inexacta, ya que la masa es una propiedad del cuerpo y el peso depende de la gravedad.
Las masas atómicas de los elementos químicos se pueden calcular con la media ponderada de las masas de los distintos isótopos de cada elemento, teniendo en cuenta la abundancia relativa de cada uno de ellos. Esto explica la no correspondencia entre lamasa atómica en umas (unidad de masa atómica) de un elemento y el número de nucleones que alberga el núcleo de su isótopo más común.
En cambio, la masa atómica de un isótopo siempre coincide, de forma aproximada, con la masa de sus nucleones. La diferencia se produce ya que los elementos no están formados por un solo isótopo, si no por una mezcla con unas ciertas abundancias para cada uno de ellos, mientras que cuando se mide lamasa de un isótopo en concreto no se tienen en cuenta las abundancias.
De todas formas, debido al defecto de masa (la diferencia entre su masa medida experimentalmente y la indicada por su número másico A), ni siquiera la masa atómica de los isótopos equivale a la suma de las masas de los nucleones.
El mol es la unidad del Sistema Internacional de Unidades que permite expresar una cantidad de sustancia. Se trata de la unidad que utilizan los químicos para expresar el peso de los átomos, que equivale a un número muy grande de partículas. Un mol equivale al número de átomos que hay en doce gramos de carbono-12 puro. La ecuación sería la siguiente: 1 mol = 6,022045 x 10 elevado a 23 partículas.
Dicha cantidad suele redondearse como 6,022 x 10 elevado a 23 y recibe el nombre de número de Avogadro o constante de Avogadro, en honor al científico italiano Amedeo Avogadro (1776-1856), quien también formuló la ley que afirma que volúmenes iguales de gases distintos, bajo las mismas condiciones de presión y temperatura, contienen igual número de partículas. La utilidadde la constante de Avogadro radica en la necesidad de contar partículas o entidades microscópicas a partir de medidas macroscópicas (como la masa).
Roman Lisbeth seccion 003 ing. Civil -
Esta magnitud tiene el mismo valor numérico que la masa molecular de dicha partícula, pero en vez de estar en unidad de masa atómica está en gramos/mol. La masa molar está relacionada con el peso molecular o masa molar relativa (Mr) de un compuesto, con las masas atómicas relativas o pesos atómicos estándar de los elementos constituyentes. Sin embargo, debe ser distinguida de la masa molecular, que es la masa de una molécula (de cualquier composición isotópica) y no está directamente relacionada con la masa atómica, que es la masa de un átomo (de cualquier composición isotópica). El Dalton, símbolo Da, también es utilizado como unidad de masa molar, especialmente en bioquímica, y se define 1 Da = 1 g/mol, a pesar del hecho de ser estrictamente una unidad de masa molecular (1 Da = 1×1027 kg). Las masas molares casi nunca son medidas directamente. Pueden ser calculadas a partir de los pesos atómicos estándar y están usualmente listadas en catálogos químicos y en la Ficha de datos de seguridad (FDS). Las masas molares varían típicamente entre:
1238 g/mol para átomos de elementos de ocurrencia natural
101.000 g/mol para compuestos químicos sencillos
1.0005.000.000 g/mol para polímeros, proteínas, fragmentos de ADN, etc.
a masa atómica (ma) es la masa de un átomo, más frecuentemente expresada en unidades de masa atómica unificada.[1] La masa atómica puede ser considerada como la masa total de protones, neutrones y electrones en un solo átomo (cuando el átomo no tiene movimiento). La masa atómica es algunas veces usada incorrectamente como un sinónimo de masa atómica relativa, masa atómica media y peso atómico; estos últimos difieren sutilmente de la masa atómica. La masa atómica está definida como la masa de un átomo, que sólo puede ser de un isótopo a la vez, y no es un promedio ponderado en las abundancias de los isótopos. En el caso de muchos elementos que tienen un isótopo dominante, la similitud/diferencia numérica real entre la masa atómica del isótopo más común y la masa atómica relativa o peso atómico estándar puede ser muy pequeña, tal que no afecta muchos cálculos bastos, pero tal error puede ser crítico cuando se consideran átomos individuales. Para elementos con más de un isótopo común, la diferencia puede llegar a ser de media unidad o más (por ejemplo, cloro). La masa atómica de un isótopo raro puede diferir de la masa atómica relativa o peso atómico estándar en varias unidades de masa.
La masa atómica (representada con la letra A), resulta de la suma de la masa de las partículas del núcleo (protones y neutrones), la masa de los electrones es tan pequeña que se considera despreciable y no aporta a la masa atómica.
Convencionalmente se considera la masa de protones y neutrones igual a 1 uma (unidad de masa atómica), por lo que la masa atómica es igual a la cantidad de partículas que existen en el núcleo.
Se expresa con expansión decimal en las tablas periódicas y otras fuentes debido a que el dato que aparece, es un promedio ponderado de las masas de los distintos isótopos del elemento que existen.
Por ejemplo. el hidrógeno (H) tiene 3 isótopos: el protio A=1 uma, el deuterio A=2 uma, y el tritio A=3 uma, su masa atómica es igual a la suma de la masa de cada isótopo, multiplicada por su abundancia relativa y todo ello dividido entre 3.
En cuanto a si redondear o no redondear, depende de la finalidad del cálculo que vas a hacer. Si por ejemplo, trabajas en un laboratorio de análisis y requieres hacer un cálculo de concentración, es recomendable que uses todos los decimales para obtener mayor precisión.
número atómico (Z) y masa atómica (M)
El Número Atómico (Z) es el número de protones que posee un átomo y este a su vez es igual al número de electrones.
*
o Por ejemplo el Co (cobalto) que tiene Z = 27, tiene 27 protones y 27 electrones.
La Masa Atómica (M) es el promedio de las masas atomicas de todos los isótopos de un átomo. Se representa en unidades relativas (uma) y para un sólo átomo, corresponde a la suma de las masas de los neutrones y los protones.
Como la masa en uma de el protón y del neutrón es = 1 , entonces se considera que la Mása atómica es la suma de neutrones más protones.
Es decir si ya se tiene el número de protones, lo que falte para la masa (la diferencia) es el número de neutrones.
Para el caso del Co , que tiene 27 protones, tiene M = 59 , lo que significa que la diferencia (M - Z) es igual a 32 , y ese es el número de neutrones.
leydi moreno -
seccion: 005
la masa molecular relativa es un número que indica cuántas veces mayor es la masa de una molécula de una sustancia con respecto a la unidad de masa atómica. Se determina sumando las masas atómicas relativas de los elementos cuyos átomos constituyen una molécula de dicha sustancia.
La formula para calcular es: % elemento X= [(núm. átomos de X)·Ar(X)/Mr]·100%
La masa molecular se calcula sumando las masas atómicas de los elementos que componen la molécula
En el caso de la molécula de agua, H2O, su masa molecular sería:
(masa atómica del H: 1,0079, masa atómica del O: 15,99994)
(Se multiplica por 2, ya que ésa es la cantidad de veces que el elemento H está presente en la molécula.)
ej: hierro:4d
La masa molar de una sustancia coincide numéricamente con la masa molecular, aunque son cosas distintas.
A pesar de que se sigue diciendo popularmente peso molecular, el término correcto es masa molecular.
Si se necesita la masa molecular de varios componentes, se multiplican por separado los átomos de cada componentes y se multiplican por la masa atómica. Luego se suman los dos. Vamos a determinar, por ejemplo, la masa molecular del componente C3H8:
Elemento = Átomos * Peso atómico
C= 3 * 12 = 36
H= 8 * 1 = 8
jesus segovia -
Jesus Segovia
C.I:19.654.965
Seccion I-005D
ing.petroquimica
II semestre
La determinación del peso molecular de los compuestos de un elemento dado permite hallar fácilmente su peso atómico. Puesto que los átomos son indivisibles, en una molécula hay, necesariamente, un número entero de átomos de cada clase y, casi siempre, un número entero sencillo. Si se determina el peso molar de los compuestos de. un elemento y, por análisis, se averigua la cantidad de elemento que existe en dichos pesos molares, las cantidades halladas son múltiplos sencillos del peso atómico gramo correspondiente (peso atómico expresado en gramos) y, por consiguiente, este peso atómico será, muy probablemente, el máximo común divisor de todas aquellas cantidades. El método se debe a CANNIZZARO por ser este químico el primero que reconoció la significación del Principio de Avogadro y su aplicación a la determinación de pesos moleculares y atómicos. También se conoce como método del máximo común divisor.
EJEMPLO. El calor específico del hierro es igual a 0,113 cal/gramo . grado. Hallar el peso atómico aproximado del hierro.
Aplicando la expresión derivada de la ley de Dulong y Petit se tiene
Peso atómico del hierro 55,7.
debe tomarse en cuenta que la presion debe estar expresada en atmósferas y el volumen
jorman caraballo 21.210.415 II semestre Ing. Petroquimica -
geirymar aguirre -
La masa no depende de la posición del cuerpo en el espacio ni de la fuerza gravedad. El kilogramo y el newton son las unidades en el sistema internacional de unidades del peso y la masa, respectivamente. La masa molecular, por lo tanto, es el resultado de la suma de las masas atómicas de los elementos que forman una molécula. En este sentido, la masa molecular relativa es el número que señala cuántas veces mayor es la masa de una molécula de una sustancia con respecto a la unidad de masa atómica.
Una unidad de masa atómica o Dalton (Da), cuyo símbolo es u (antiguamente era uma), equivale a la duodécima (1/12) parte de la masa de un átomo de carbono-12.
Por ejemplo, cuando decimos que el Li tiene una masa de 6,94 o queremos decir que un átomo de litio tiene la misma masa que 6,94 veces la masa de 1/12 parte de un átomo de carbono-12.
1 g equivale a la masa 1 mol (NA) de unidades de masa atómica. Así pues, un mol de átomos de carbono-12 tiene una masa de 12 g.
Las masas atómicas de los elementos químicos dadas en u son calculadas con la media ponderada de las masas de los distintos isótopos de cada elemento.
Por ejemplo, la masa molecular del NO2 se calcula de la siguiente forma:
Masa ponderada del átomo de N ≈ 14,00 u → 14×1=14 u
Masa ponderada de la molécula diatómica de O2 , si O ≈ 16,00 u → 16×2=32 u
Masa de una molécula de NO2 = 14 + 32 = 46 u
Entonces, NA moléculas de NO2, los cuales componen un mol de moléculas de NO2, tendrían una masa de 46 g. Entonces la masa molecular del NO2 es 46 g/mol.
Erróneamente se tiende a utilizar el término peso atómico o molecular, pero el término correcto es masa.
El valor de 1 u en gramos se obtiene dividiendo 12 gramos entre 12 por el número de Avogadro: O lo que es lo mismo, la inversa del número de Avogadro 1/ (6,022 141 99 × 1023).
De esta forma encontramos que:
1 u = 1,660 538 86 × 10-27 kg = 931,494028 MeV/c2
katherine alvarado. ing-petroquimica. seccion:I 005d -
Ejemplo:
2 Fe + O2 → 2 FeO
Consultando una tabla periódica podemos ver que la masa atómica del Fe es 56 uma y la masa molecular del O2 es 32 uma, mientras que la masa del FeO es 56 + 16 = 72 uma. Al observar la reacción ajustada, vemos que la relación de masas que intervienen en la reacción es:
2 masa Fe + masa O2 → 2 masa FeO
Es decir:
2 56 + 32 → 2 72
La misma relación de masas atómicas o moleculares se cumple tanto en unidades de masa atómica como en gramos o en kilogramos. Por tanto, se puede afirmar que 112 g de hierro reaccionan con 32 g de oxígeno atmosférico para producir 144 g de FeO.
Procedimiento de cálculo con reacciones químicas
1.- Ajusta la reacción química.
2.- Determina las masas atómicas o moleculares de las sustancias que intervienen.
3.- Multiplica dichas masas por los correspondientes números enteros que has escrito antes para ajustar la reacción.
4.- Los valores obtenidos, expresados en cualquier unidad de masa, indican las cantidades de reactivo y de producto que intervienen en la reacción.La masa isotópica relativa es la masa relativa de un isótopo dado (más específica, cualquier núclido solo), escalado con el carbono-12 como exactamente 12. y teoría atómica Dalton establece que los átomos de los distintos elementos tienen masas diferentes.
Yulay Acosta -
Ing:Petroquimica
Seccion:I.005
La masa molecular relativa es un número que indica cuántas veces mayor es la masa de una molécula de una sustancia con respecto a la unidad de masa atómica. Se determina sumando las masas atómicas relativas de los elementos cuyos átomos constituyen una molécula de dicha sustancia.
La formula para calcular es: % elemento X= [(núm. átomos de X)·Ar(X)/Mr]·100%
La masa molecular se calcula sumando las masas atómicas de los elementos que componen la molécula
En el caso de la molécula de agua, H2O, su masa molecular sería:
(masa atómica del H: 1,0079, masa atómica del O: 15,99994)
(Se multiplica por 2, ya que ésa es la cantidad de veces que el elemento H está presente en la molécula.)
ej: hierro:4d
La masa molar de una sustancia coincide numéricamente con la masa molecular, aunque son cosas distintas.
A pesar de que se sigue diciendo popularmente peso molecular, el término correcto es masa molecular.
Si se necesita la masa molecular de varios componentes, se multiplican por separado los átomos de cada componentes y se multiplican por la masa atómica. Luego se suman los dos. Vamos a determinar, por ejemplo, la masa molecular del componente C3H8:
Elemento = Átomos * Peso atómico
C= 3 * 12 = 36
H= 8 * 1 = 8
MARIA G JIMENEZ -
ING.PETROQUIMICA II-005
Masa molecular.
La masa molecular es la suma de las masas atómicas (en 'uma' o simplemente 'u') en una molécula. En algunos textos todavía se denomina como 'peso molecular' a la 'masa molecular'.
Para calcularla debemos saber las masas atómicas de cada uno de los elementos que intervienen en el compuesto.
Por consiguiente, el peso molecular del cloro es 70,9
EJEMPLO. Calcular la cantidad de vapor de agua que hay en el aire de una habitación cuyas dimensiones son 5,10 m de larga, 4,30 m de ancha Y 3,20 m de alta, si la humedad relativa es del 70% y la temperatura ambiente es de 23.ºC La presión de vapor del agua a 23 ºC es 21,07 mm y un mol de agua pesa 18,016 gramos.
El vapor de agua ocupa el volumen de la habitación iguaI a 5,10 x 4,30 x 3,2 m3 o sea 70,18 m3 equivalentes a 70180 litros, Y su presión gaseosa, presión parcial en el aire, es el 70% de 21,07 mm, o sea I4,75 milímetros.
En la expresión despejaremos el valor de a y substituiremos los demás por sus magnitudes conocidas.
Si se necesita la masa molecular de varios componentes, se multiplican por separado los átomos de cada componentes y se multiplican por la masa atómica. Luego se suman los dos. Vamos a determinar, por ejemplo, la masa molecular del componente C3H8:
Elemento = Átomos * Peso atómico
La masa atómica relativa es un sinónimo para peso atómico y está cercanamente relacionado a masa atómica promedio (pero no es un sinónimo de masa atómica), la media ponderada de las masas atómicas de todos los átomos de un elemento químico encontrados en una muestra particular, ponderados por abundancia isotópica.Esto es usado frecuentemente como sinónimo para peso atómico relativo, y no es incorrecto hacer así, dado que los pesos atómicos estándar son masas atómicas relativas, aunque es menos específico. La masa atómica relativa también se refiere a ambientes no terrestres y ambientes terrestres altamente específicos que se desvían de la media o tienen diferentes certidumbres (número de cifras significativas) que los pesos atómicos estándar.
La masa isotópica relativa es la masa relativa de un isótopo dado (más específica, cualquier núclido solo), escalado con el carbono-12 como exactamente 12. No hay otros núclidos distintos al carbono-12 que tengan exactamente un número entero de masas en esta escala. Esto es debido a dos factores:la diferente masa de neutrones y protones que actúan para cambiar la masa total en los núclidos con ratios protón/neutrón distintos al ratio 1:1 del carbono-12; y no se encontrará un número exacto si existe una pérdida/ganancia de masa diferente a la energía de enlace nuclear relativa a la energía de enlace nuclear media del carbono-12.
C= 3 * 12 = 36
H= 8 * 1 = 8
La masa atómica relativa es un sinónimo para peso atómico y está cercanamente relacionado a masa atómica promedio (pero no es un sinónimo de masa atómica), la media ponderada de las masas atómicas de todos los átomos de un elemento químico encontrados en una muestra particular, ponderados por abundancia isotópica.Esto es usado frecuentemente como sinónimo para peso atómico relativo, y no es incorrecto hacer así, dado que los pesos atómicos estándar son masas atómicas relativas, aunque es menos específico. La masa atómica relativa también se refiere a ambientes no terrestres y ambientes terrestres altamente específicos que se desvían de la media o tienen diferentes certidumbres (número de cifras significativas) que los pesos atómicos estándar.
La masa isotópica relativa es la masa relativa de un isótopo dado (más específica, cualquier núclido solo), escalado con el carbono-12 como exactamente 12. No hay otros núclidos distintos al carbono-12 que tengan exactamente un número entero de masas en esta escala. Esto es debido a dos factores:la diferente masa de neutrones y protones que actúan para cambiar la masa total en los núclidos con ratios protón/neutrón distintos al ratio 1:1 del carbono-12; y no se encontrará un número exacto si existe una pérdida/ganancia de masa diferente a la energía de enlace nuclear relativa a la energía de enlace nuclear media del carbono-12.
maria perdomo 20.4445.212 Ing.petroquImica 005 -
Masa molecular.
La masa molecular es la suma de las masas atómicas (en 'uma' o simplemente 'u') en una molécula. En algunos textos todavía se denomina como 'peso molecular' a la 'masa molecular'.
1. Para calcularla debemos saber las masas atómicas de cada uno de los elementos que intervienen en el compuesto.
2. Empezaremos por uno de los lados de la fórmula, por ejemplo el izquierdo.
3. Multiplicaremos el subíndice del elemento (cuando no existe se asume que es 1) por la masa atómica del mismo.
4. Procederemos de la misma forma con todos los elementos.
5. Sumaremos los resultados de todas las multiplicaciones y de esta forma tendremos la masa molecular expresada en unidades de masa atómica ('uma' o 'u').
Ejemplo de cálculo de masas moleculares en formato flash (puede tardar un poco en abrirse)
Otros ejemplos:
Si la fórmula tiene un paréntesis, multiplicaremos cada uno de los subíndices que se encuentren dentro del paréntesis por el número que viene como subíndice del paréntesis.
Composición porcentual a partir de la fórmula.
El porcentaje en peso de cada uno de los elementos en un compuesto siempre debe ser el mismo, independientemente de la cantidad de compuesto que tengamos; es decir, si un compuesto orgánico tiene un 40% en peso del elemento carbono (C), lo tendrá tengamos un gramo o una tonelada de dicho compuesto: el 40% de esa cantidad será carbono.
¿Cómo se calcula la composición porcentual? Para contestar la pregunta utilizaremos un ejemplo. Calculemos el porcentaje en peso de los elementos que hay en el SO3 (MS = 32 u ; MO = 16 u).
1. Calcularemos la masa molecular del compuesto:
2. Calculamos el número de unidades de masa atómica del primer elemento de la fórmula (masa atómica multiplicada por el número de átomos que hay de dicho elemento en la fórmula. Dicho número lo dividimos por la masa molecular (masa de todo el compuesto en unidades de masa atómica) y el resultado se multiplica por cien. Fíjate que el cociente debe ser inferior a la unidad dado que la masa de cada elemento en la fórmula debe ser inferior al total (hay otros elementos). Al multiplicar un cociente inferior a la unidad por cien el resultado será inferior a cien. Si es necesario se suele redondear el porcentaje a un decimal.
donde nS es el número de átomos de S (azufre) que hay en el compuesto.
3. Repetimos el proceso con cada uno de los otros elementos.
donde nO es el número de átomos de O (oxígeno) que hay en el compuesto.
4. Para comprobar si los cálculos son correctos debemos sumar todos los porcentajes. La suma debe ser el 100% (admitimos ±0,1% por errores de decimales al dividir). En nuestro ejemplo, si sumamos los dos porcentajes nos da el 100%.
Importante. Conviene calcular todos los porcentajes, incluido el último; o sea, no calcules el último restando a 100% la suma de los otros. ¿Por qué? Para comprobar si cometes errores, si lo haces restando nuca sabrás si has cometido errores al calcular alguno de los porcentajes dado que la suma siempre saldría el cien por cien.
Determinación de la fórmula empírica.
Para determinar la fórmula empírica debemos conocer el porcentaje en peso de cada elemento en el compuesto y las masas atómicas de cada uno de ellos. Por ejemplo, supongamos que tenemos 40,00% de C, 6,67% de H y 53,33% de O. Las masas atómicas son MC=12u, MH=1u, MO=16u.
Seguiremos los siguientes pasos:
1. Consideramos 100 g de compuesto: el porcentaje de cada uno serán los gramos de cada elemento que hay en 100 g de compuesto. Siguiendo el ejemplo, tendremos 40,00 g de C, 6,67 g de H y 53,33 g de O.
2. Dividimos cada masa por la masa atómica del elemento correspondiente:
C: 40,00 / 12 = 3,33
H: 6,67 / 1 = 6,67
O: 53,33 / 16 = 3,33
3. Ahora dividimos cada uno de los resultados anteriores por el más pequeño de ellos, en este caso por 3,33:
C: 3,33 / 3,33 = 1
H: 6,67 / 3,33 = 2
O: 3,33 / 3,33 = 1
4. El resultado debe ser un número entero, los números enteros más pequeños, y la fórmula empírica sería C1H2O1, quitando los unos quedaría CH2O como fórmula empírica.
Determinación de la fórmula molecular.
Para conocer la fórmula molecular, debemos tener los mismos datos de partida que para la fórmula empírica (porcentajes y masas atómica) y, además, la masa molecular del compuesto (en nuestro ejemplo sería 180 u).
Seguiríamos los mismos cuatro pasos del caso anterior para determinar la fórmula empírica y continuaríamos de la siguiente forma:
5. Calculamos la masa molecular con la fórmula empírica. En nuestro ejemplo sería sobre el compuesto de fórmula empírica CH2O:
6. Ahora dividimos la masa molecular real que nos han dado, entre la masa calculada con la fórmula empírica:
masa molecular / masa fórmula empírica = 180 / 30 = 6
7. El resultado nos indica el número de veces que la fórmula molecular será la fórmula empírica. Para escribir la fórmula molecular multiplicaremos cada subíndice de la fórmula empírica por el número obtenido de la división:
C16 H26 O16 > C6H12O6
Por tanto, la fórmula molecular será en nuestro caso C6H12O6
Nota: Diferencia entre fórmula empírica y fórmula molecular
teolileth chavez ingpetroqumica 005 -
De Wikipedia, la enciclopedia libre
Saltar a navegación, búsqueda
La masa molecular relativa es un número que indica cuántas veces mayor es la masa de una molécula de una sustancia con respecto a la unidad de masa atómica. Se determina sumando las masas atómicas relativas de los elementos cuyos átomos constituyen una molécula de dicha sustancia.
La formula para calcular es: % elemento X= [(núm. átomos de X)·Ar(X)/Mr]·100%
La masa molecular se calcula sumando las masas atómicas de los elementos que componen la molécula
En el caso de la molécula de agua, H2O, su masa molecular sería:
(masa atómica del H: 1,0079, masa atómica del O: 15,99994)
(Se multiplica por 2, ya que ésa es la cantidad de veces que el elemento H está presente en la molécula.)
ej: hierro:4d
La masa molar de una sustancia coincide numéricamente con la masa molecular, aunque son cosas distintas.
A pesar de que se sigue diciendo popularmente peso molecular, el término correcto es masa molecular.
Si se necesita la masa molecular de varios componentes, se multiplican por separado los átomos de cada componentes y se multiplican por la masa atómica. Luego se suman los dos. Vamos a determinar, por ejemplo, la masa molecular del componente C3H8:
Elemento = Átomos * Peso atómico
C= 3 * 12 = 36
H= 8 * 1 = 8
Masa molecular= 44 g/mol
Jesiree Diaz 20.194.534 Ing.Petroquimica -005 -
Determinación de masas moleculares de gases.
Determinación de masas atómicas.
En los postulados de la teoría atómica Dalton establece que los átomos de los distintos elementos tienen masas diferentes. Por otra parte, lo que ocurre en las reacciones químicas es una interacción de átomos, por lo que las sustancias no reaccionan entre sí gramo a gramo y resulta necesario conocer las masas de aquellos. Como éstas son sumamente pequeñas, se recurrió al procedimiento de determinar su masa relativa. O lo que es equivalente, encontrar cuán pesado era un átomo de un elemento comparado con un átomo de otro elemento. Para esto, habría que tomar los átomos de un determinado elemento como patrón de referencia, patrón que sería elegido arbitrariamente. El número resultante de la comparación de los pesos respectivos de esos dos átomos es lo que se denominó peso atómico.
En un principio, se tomó el hidrógeno como patrón, por su cualidad de ser el elemento más ligero, y se le adjudicó también arbitrariamente el peso unidad. A la masa correspondiente se la denominó «unidad atómicá de masa» (uam) y también «dalton».
La realización de estas primeras medidas tuvo como base teórica lá hipótesis de Avogadro: como dos volúmenes iguales de gases distintos -en iguales condiciones de presión y temperatura- contienen el mismo número de moléculas, la relación de pesos de esos dos volúmenes dará la relación de pesos de sus moléculas respectivas. Así, por ejemplo, como un volumen de oxígeno (O2) pesa 16 veces más que el mismo volumen de hidrógeno (H2), a igualdad de presión y temperatura, el peso de una molécula de O2 es 16 veces mayor que el de una molécula de H2. Se obtuvo así una escala de pesos moleculares y de ella una de pesos atómicos. (Actualmente, las masas atómicas relativas se determinan con enorme precisión en el aparato denominado espectrómetro de masas).
Debido al difícil manejo del hidrógeno y, sobre todo, a que con él se obtenían pesos moleculares no enteros para muchos gases, se adoptó como nuevo patrón al oxígeno en lugar del hidrógeno. Al átomo de oxígeno se le asignó, también arbitrariamente, una masa atómica de 16 uam. En la actualidad y desde 1961, para unificar criterios, la IUPAC (International Union 0f Pure and Applied Chemistry) acordó utilizar un nuevo patrón: el isótopo del carbono de número másico 12 (que se representa como C12 ó como C-12), al que se le adjudicó la masa atómica exacta de 12 uam. (Isótopos son átomos de un mismo elemento que sólo difieren en su masa. Los elementos se presentan en la naturaleza como mezclas de varios isótopos).
De esta manera, el que el cloro tenga, por ejemplo, un peso atómico de 35,5, significa que sus átomos son 35,5 veces más pesados que 1/12 del átomo de C12.
En definitiva, hay que considerar que:
a) El peso atómico de un elemento es un peso relativo, comparado con el peso de un átomo de C-12.
b) El peso atómico de un elemento es, en realidad, el peso atómico medio de todos los isótopos de ese elemento, teniendo en cuenta la cantidad relativa de cada isótopo, tal como se presenta dicho elemento en la naturaleza (abundancia relativa)
c) En compuestos, habremos de referirnos a pesos moleculares, suma de los pesos atómicos de todos los átomos que constituyen su molécula.
Aunque los términos de peso atómico y molecular están muy extendidos, es más correcto hablar de masa atómica y molecular, ya que el peso deriva de la masa, necesitando la acción de un campo gravitatorio para su puesta en evidencia. Sin embargo, tradicionalmente se suele utilizar el término de peso atómico para designar la masa atómica media de un elemento teniendo en cuenta sus isótopos, y el de masa atómica para designar la masa de los átomos de cada isótopo de un elemento. Esta es la terminología más extendida que se utiliza. Los pesos atómicos de todos los elementos conocidos se encuentran recogidos en la actualidad en la Tabla Periódica.
Determinación de masas moleculares de gases.
Método de densidades relativas.
Método de densidades absolutas
Método de densidades relativas.
El Principio de Avogadro (página 42), al establecer que en un volumen dado gaseoso, medido siempre en las mismas condiciones de presión y temperatura, existe un número invariable de moléculas cualquiera que sea el gas contenido, permite conocer el peso molecular relativo de ellas puesto que la relación en peso de dos de dichos volúmenes, esto es, la densidad relativa de un gas respecto al otro, ha de ser igual a la relación entre el peso de sus moléculas. Esto es,
y como la primera relación es la densidad relativa del gas A respecto del B, expresada por DA (B), y en la segunda relación puede cancelarse el factor común n, número igual de moléculas en los dos gases, resulta
o sea, Peso molecular del gas = Peso molecular del gas B x DA (B)
Si se conociese el peso de una molécula de una sustancia gaseosa cualquiera podría hallarse el peso molecular de cualquier otro gas con sólo determinar la densidad relativa de éste respecto al primero. Si tomamos como referencia la masa molecular del oxígeno (32,000) obtenemos:
Pesó molecular gas A = 32,000 x DA (Oxígeno)
Método de densidades absolutas
Partiendo de la forma general de la ecuación de estado de los gases ideales, PV = nRT, se pueden obtener las masas moleculares de las sustancias gaseosas o fácilmente volátiles.
El número de moles n, en un volumen de gas viene dado por a/M siendo a el número de gramos de la sustancia gaseosa y M su masa molar. En consecuencia, la ecuación general de los gases toma la forma
expresión esta última que da el peso molar de la sustancia en función de magnitudes directamente determinables.
Puesto que a / V es la densidad absoluta del gas en las condiciones experimentales de presión y temperatura, se tiene,
expresión que da el valor del peso molar de la sustancia en función de su densidad absoluta como gas en cualesquiera condiciones de presión y temperatura.
La aplicación de estas ecuaciones derivadas de la ecuación de estado al cálculo de pesos moleculares de gases o de substancias que pueden pasar fácilmente al estado gaseoso o bien a la determinación de alguna otra magnitud referente a una masa de gas, queda de manifiesto en los los ejemplos siguientes; el primero es el resuelto anteriormente mediante varios pasos sucesivos.
EJEMPLO. A 21 ºC y 742mm, O,583g de cloro ocupan un volumen de 203cm3. Calcular el peso molecular del cloro.
El cálculo se reduce simplemente a sustituir valores e. la expresión teniendo en cuenta que la presión debe estar expresada en atmósferas y el volumen en litros puesto que la constante R viene dada en atmósferas por litros partido de grado Kelvin y mol. Se tiene
Por consiguiente, el peso molecular del cloro es 70,9
EJEMPLO. Calcular la cantidad de vapor de agua que hay en el aire de una habitación cuyas dimensiones son 5,10 m de larga, 4,30 m de ancha Y 3,20 m de alta, si la humedad relativa es del 70% y la temperatura ambiente es de 23.ºC La presión de vapor del agua a 23 ºC es 21,07 mm y un mol de agua pesa 18,016 gramos.
El vapor de agua ocupa el volumen de la habitación iguaI a 5,10 x 4,30 x 3,2 m3 o sea 70,18 m3 equivalentes a 70180 litros, Y su presión gaseosa, presión parcial en el aire, es el 70% de 21,07 mm, o sea I4,75 milímetros.
En la expresión despejaremos el valor de a y substituiremos los demás por sus magnitudes conocidas. Se tiene
Cuando los gases discrepan mucho del comportamiento ideal, tal como a grandes presiones y bajas temperaturas, debe aplicarse la ecuación de van der Waals
en la que V es el volumen molar y a y b las correspondientes constantes.
Determinación de masas atómicas
Método de Cannizzaro
Masas atómicas aproximadas. ley de Dulong y Petit.
Método de Cannizzaro
La determinación del peso molecular de los compuestos de un elemento dado permite hallar fácilmente su peso atómico. Puesto que los átomos son indivisibles, en una molécula hay, necesariamente, un número entero de átomos de cada clase y, casi siempre, un número entero sencillo. Si se determina el peso molar de los compuestos de. un elemento y, por análisis, se averigua la cantidad de elemento que existe en dichos pesos molares, las cantidades halladas son múltiplos sencillos del peso atómico gramo correspondiente (peso atómico expresado en gramos) y, por consiguiente, este peso atómico será, muy probablemente, el máximo común divisor de todas aquellas cantidades. El método se debe a CANNIZZARO por ser este químico el primero que reconoció la significación del Principio de Avogadro y su aplicación a la determinación de pesos moleculares y atómicos. También se conoce como método del máximo común divisor.
El siguiente cuadro tabula los datos experimentales y calculados conducentes a la determinación del peso atómico - del cloro, el cual resulta igual a 35,5. Este valor es aproximado por serlo también los pesos moleculares encontrados de los correspondientes compuestos.
Masas atómicas aproximadas. ley de Dulong y Petit.
El método de Cannizzaro no puede utilizarse para la determinación del peso atómico de los elementos metálicos puesto que, en general, estos elementos no forman compuestos volátiles. Afortunadamente pudo encontrarse una relación entre el peso atómico y su calor especifico al observar DULONG y PETIT que el producto del calor específico de cualquier elemento sólido por su peso atómico es prácticamente constante e igual a 6,3.
Puesto que el calor específico es la cantidad de calor necesaria para elevar en un grado centígrado la temperatura de un gramo del cuerpo, este producto corresponde a la capacidad calorífica de un mol.
La ley de Dulong y Petit puede enunciarse en la forma siguiente:
Los calores atómicos de los elementos en estado sólido son prácticamente iguales a 6,3.
(Dimensionalmente, este valor viene expresado en cal/ºC. mol.) Por consiguiente,
Calor específico x Peso atómico = 6,3 o sea, Peso atómico = 6,3 / Calor específico
La ley de Dulong y Petit no es muy exacta y además no puede aplicarse a elementos de peso atómico bajo tal como el berilio, boro, carbono y silicio para los cuales el calor atómico es excepcionalmente muy bajo.
EJEMPLO. El calor específico del hierro es igual a 0,113 cal/gramo . grado. Hallar el peso atómico aproximado del hierro.
Aplicando la expresión derivada de la ley de Dulong y Petit se tiene
Peso atómico del hierro 55,7.
engels matos I-003D ing. civil -
La formula para calcular es: % elemento X= [(núm. átomos de X)·Ar(X)/Mr]·100%
La masa molecular se calcula sumando las masas atómicas de los elementos que componen la molécula
En el caso de la molécula de agua, H2O, su masa molecular sería:
(masa atómica del H: 1,0079, masa atómica del O: 15,99994)
(Se multiplica por 2, ya que ésa es la cantidad de veces que el elemento H está presente en la molécula.)
ej: hierro:4d
La masa molar de una sustancia coincide numéricamente con la masa molecular, aunque son cosas distintas.
A pesar de que se sigue diciendo popularmente peso molecular, el término correcto es masa molecular.
Si se necesita la masa molecular de varios componentes, se multiplican por separado los átomos de cada componentes y se multiplican por la masa atómica. Luego se suman los dos. Vamos a determinar, por ejemplo, la masa molecular del componente C3H8:
Elemento = Átomos * Peso atómico
C= 3 * 12 = 36
H= 8 * 1 = 8
milianyer Landaeta Ing.Civil 003 2 semestre -
La masa molar se calcula usando la tabla periódica de los elementos. En el caso de la molecula de agua, contiene 2 átomos de hidrógeno con una masa atómica de 1.008 uma y uno de oxígeno con una masa atómica de 16.0 uma (redondeada). Al sumar estas dos masas, se obitene una masa molecular de 18 gramos (redondeada). Por tanto la masa de un mol de agua es de 18 gramos. Su masa molar o peso molecular es 18 g/mol. 5 moles de moléculas tendran una masa de:
5 mol × (18g/mol) = 90 g
Podríamos decir que 6.02×1023 moléculas de agua tienen una masa de 18 g.
Masa molar de los compuestos.-
Un mol de un compuesto contiene el número de Avogadro de unidades fórmula (moléculas o iones) del mismo. Los términos peso molecular, masa molecular, peso fórmula y masa fórmula se han usado para referirse a la masa de 1 mol de un compuesto. El término de masa molar es más amplio pues se puede aplicar para todo tipo de compuestos.
A partir de la fórmula de un compuesto, podemos determinar la masa molar sumando las masas atómicas de todos los átomos de la fórmula. Si hay más de un átomo de cualquier elemento, su masa debe sumarse tantas veces como aparezca.
Ejemplos: Calcule la masa molar de los siguientes compuestos.
KOH (hidróxido de potasio)
K 1 x 39.10 = 39.10
O 1 x 16.00 = 16.00
H 1 x 1.01 = 1.01 +
56.11 g
Yessica Flores Ing. Civil I-003 2do semestre -
Masa atómicaLa masa atómica también suele recibir el nombre de peso atómico, aunque esta denominación es inexacta, ya que la masa es una propiedad del cuerpo y el peso depende de la gravedad.
Las masas atómicas de los elementos químicos se pueden calcular con la media ponderada de las masas de los distintos isótopos de cada elemento, teniendo en cuenta la abundancia relativa de cada uno de ellos. Esto explica la no correspondencia entre lamasa atómica en umas (unidad de masa atómica) de un elemento y el número de nucleones que alberga el núcleo de su isótopo más común.
En cambio, la masa atómica de un isótopo siempre coincide, de forma aproximada, con la masa de sus nucleones. La diferencia se produce ya que los elementos no están formados por un solo isótopo, si no por una mezcla con unas ciertas abundancias para cada uno de ellos, mientras que cuando se mide lamasa de un isótopo en concreto no se tienen en cuenta las abundancias.
De todas formas, debido al defecto de masa (la diferencia entre su masa medida experimentalmente y la indicada por su número másico A), ni siquiera la masa atómica de los isótopos equivale a la suma de las masas de los nucleones.
el peso es la fuerza con que la Tierra atrae a un cuerpo. El término también se utiliza para referirse a la magnitud de dicha fuerza. La masa, por otra parte, es la magnitud física que expresa la cantidad de materia que contiene un cuerpo.
Peso molecularEsa es la diferencia entre el peso y la masa. La masa no depende de la posición del cuerpo en el espacio ni de la fuerza gravedad. El kilogramo y el newton son las unidades en el sistema internacional de unidades del peso y la masa, respectivamente.
Esta diferenciación entre ambos conceptos implica que la noción de peso molecular sea imprecisa. Lo correcto es hablar de masa molecular, una magnitud que se mide en unidades de masa atómica (uma).
Cabe destacar que una molécula es la partícula más pequeña que presenta todas las propiedades físicas y químicas de una sustancia, y que se encuentra formada por uno o más átomos.
La masa molecular, por lo tanto, es el resultado de la suma de las masas atómicas de los elementos que forman una molécula. En este sentido, la masa molecular relativa es el número que señala cuántas veces mayor es la masa de una molécula de una sustancia con respecto a la unidad de masa atómica.
Para calcular el peso molecular, es necesario considerar la fórmula molecular del compuesto y los pesos atómicos de los elementos que lo componen, y multiplicar cada peso atómico por el subíndice que corresponde al elemento de acuerdo a su fórmula molecular.
JOSE VIDAL PETROQUIMICA SECCION I055 -
C.I:22.984.980
SECCION:I005
masa molecular (abreviado Sr.) de a sustancia, también llamado antes peso molecular y abreviado como MW, es masa de uno molécula de esa sustancia, concerniente a unidad de masa atómica unificada u (igual a 1/12 de la masa de una átomo de carbon-12). Esto es distinto de masa molecular relativa de una molécula, que es el cociente de la masa de esa molécula a 1/12 de la masa del carbón 12 y es un número sin dimensiones. La masa molecular relativa se abrevia a Sr..
masa molar de una sustancia está la masa de 1 mol (la unidad del SI para la cantidad del SI de la base cantidad de sustancia, teniendo el símbolo n) de la sustancia. Esto tiene un valor numérico que sea la masa molecular media de las moléculas en la sustancia multiplicada cerca Constante de Avogadro aproximadamente 6.022*1023. Las unidades mas comunes de la masa molar son g/mol porque en esas unidades el valor numérico iguala la masa molecular media en unidades del U.
Factor de la conversión de la masa molecular media a la masa molar:
masa molar = masa molecular del promedio * ((1/6.022) *10-23g/u) * (6.022*1023/mol)
o
masa molar en la masa molecular media de g/mol= en u
JOSELUIS FIGUEIRA ING.PETROQUIMICA SECCION:I005 -
La masa molecular relativa es un número que indica cuántas veces mayor es la masa de una molécula de una sustancia con respecto a la unidad de masa atómica. Se determina sumando las masas atómicas relativas de los elementos cuyos átomos constituyen una molécula de dicha sustancia.
La formula para calcular es: % elemento X= [(núm. átomos de X)·Ar(X)/Mr]·100%
La masa molecular se calcula sumando las masas atómicas de los elementos que componen la molécula
En el caso de la molécula de agua, H2O, su masa molecular sería:
(masa atómica del H: 1,0079, masa atómica del O: 15,99994)
(Se multiplica por 2, ya que ésa es la cantidad de veces que el elemento H está presente en la molécula.)
ej: hierro:4d
La masa molar de una sustancia coincide numéricamente con la masa molecular, aunque son cosas distintas.
A pesar de que se sigue diciendo popularmente peso molecular, el término correcto es masa molecular.
Si se necesita la masa molecular de varios componentes, se multiplican por separado los átomos de cada componentes y se multiplican por la masa atómica. Luego se suman los dos. Vamos a determinar, por ejemplo, la masa molecular del componente C3H8:
Elemento = Átomos * Peso atómico
C= 3 * 12 = 36
H= 8 * 1 = 8
jhon quevedo C.I 20.383.960 -
El método se debe a CANNIZZARO por ser este químico el primero que reconoció la significación del Principio de Avogadro y su aplicación a la determinación de pesos moleculares y atómicos. También se conoce como método del máximo común divisor.
El siguiente cuadro tabula los datos experimentales y calculados conducentes a la determinación del peso atómico - del cloro, el cual resulta igual a 35,5. Este valor es aproximado por serlo también los pesos moleculares encontrados de los correspondientes compuestos.
Masas atómicas aproximadas. ley de Dulong y Petit.
El método de Cannizzaro no puede utilizarse para la determinación del peso atómico de los elementos metálicos puesto que, en general, estos elementos no forman compuestos volátiles. Afortunadamente pudo encontrarse una relación entre el peso atómico y su calor especifico al observar DULONG y PETIT que el producto del calor específico de cualquier elemento sólido por su peso atómico es prácticamente constante e igual a 6,3.
Puesto que el calor específico es la cantidad de calor necesaria para elevar en un grado centígrado la temperatura de un gramo del cuerpo, este producto corresponde a la capacidad calorífica de un mol.
La ley de Dulong y Petit puede enunciarse en la forma siguiente:
Los calores atómicos de los elementos en estado sólido son prácticamente iguales a 6,3.
(Dimensionalmente, este valor viene expresado en cal/ºC. mol.) Por consiguiente,
Calor específico x Peso atómico = 6,3 o sea, Peso atómico = 6,3 / Calor específico
EJEMPLO. El calor específico del hierro es igual a 0,113 cal/gramo . grado. Hallar el peso atómico aproximado del hierro.
Aplicando la expresión derivada de la ley de Dulong y Petit se tiene
Peso atómico del hierro 55,7.
paolix oropeza CI:20055094 ingenieria civil I-003 -
la nomenclatura inorgánica añade principalmente a los compuestos inorgánicos más comunes.
Definiendo el número de oxidación de un elemento, como la carga que adquiere un átomo según el número de electrones cedidos (número de oxidación positivo), captados (número de oxidación negativo), o bien compartidos (cuando se trata de elementos) al formar un compuesto.
Esta definición es perfectamente válida para compuestos iónicos o electrovalentes
Leandro Quiroz -
El peso atómico estándar se refiere a la media de las masas atómicas relativas de un elemento en el medio local de la corteza terrestre y la atmósfera terrestre, como está determinado por la Commission on Atomic Weights and Isotopic Abundances (Comisión de Pesos Atómicos y Abundancias Isotópicas) de la IUPAC.Estos valores son los que están incluidos en una tabla periódica estándar, y es lo que es más usado para los cálculos ordinarios.
La masa atómica relativa es un sinónimo para peso atómico y está cercanamente relacionado a masa atómica promedio (pero no es un sinónimo de masa atómica), la media ponderada de las masas atómicas de todos los átomos de un elemento químico encontrados en una muestra particular, ponderados por abundancia isotópica.Esto es usado frecuentemente como sinónimo para peso atómico relativo, y no es incorrecto hacer así, dado que los pesos atómicos estándar son masas atómicas relativas, aunque es menos específico. La masa atómica relativa también se refiere a ambientes no terrestres y ambientes terrestres altamente específicos que se desvían de la media o tienen diferentes certidumbres (número de cifras significativas) que los pesos atómicos estándar.
La masa isotópica relativa es la masa relativa de un isótopo dado (más específica, cualquier núclido solo), escalado con el carbono-12 como exactamente 12. No hay otros núclidos distintos al carbono-12 que tengan exactamente un número entero de masas en esta escala. Esto es debido a dos factores:la diferente masa de neutrones y protones que actúan para cambiar la masa total en los núclidos con ratios protón/neutrón distintos al ratio 1:1 del carbono-12; y no se encontrará un número exacto si existe una pérdida/ganancia de masa diferente a la energía de enlace nuclear relativa a la energía de enlace nuclear media del carbono-12.
Determinación de masas atómicas
Método de Cannizzaro
Masas atómicas aproximadas. ley de Dulong y Petit.
Método de Cannizzaro
La determinación del peso molecular de los compuestos de un elemento dado permite hallar fácilmente su peso atómico. Puesto que los átomos son indivisibles, en una molécula hay, necesariamente, un número entero de átomos de cada clase y, casi siempre, un número entero sencillo. Si se determina el peso molar de los compuestos de. un elemento y, por análisis, se averigua la cantidad de elemento que existe en dichos pesos molares, las cantidades halladas son múltiplos sencillos del peso atómico gramo correspondiente (peso atómico expresado en gramos) y, por consiguiente, este peso atómico será, muy probablemente, el máximo común divisor de todas aquellas cantidades. El método se debe a CANNIZZARO por ser este químico el primero que reconoció la significación del Principio de Avogadro y su aplicación a la determinación de pesos moleculares y atómicos. También se conoce como método del máximo común divisor.
El siguiente cuadro tabula los datos experimentales y calculados conducentes a la determinación del peso atómico - del cloro, el cual resulta igual a 35,5. Este valor es aproximado por serlo también los pesos moleculares encontrados de los correspondientes compuestos.
Masas atómicas aproximadas. ley de Dulong y Petit.
El método de Cannizzaro no puede utilizarse para la determinación del peso atómico de los elementos metálicos puesto que, en general, estos elementos no forman compuestos volátiles. Afortunadamente pudo encontrarse una relación entre el peso atómico y su calor especifico al observar DULONG y PETIT que el producto del calor específico de cualquier elemento sólido por su peso atómico es prácticamente constante e igual a 6,3.
Puesto que el calor específico es la cantidad de calor necesaria para elevar en un grado centígrado la temperatura de un gramo del cuerpo, este producto corresponde a la capacidad calorífica de un mol.
La ley de Dulong y Petit puede enunciarse en la forma siguiente:
Los calores atómicos de los elementos en estado sólido son prácticamente iguales a 6,3.
(Dimensionalmente, este valor viene expresado en cal/ºC. mol.) Por consiguiente,
Calor específico x Peso atómico = 6,3 o sea, Peso atómico = 6,3 / Calor específico
La ley de Dulong y Petit no es muy exacta y además no puede aplicarse a elementos de peso atómico bajo tal como el berilio, boro, carbono y silicio para los cuales el calor atómico es excepcionalmente muy bajo.
EJEMPLO. El calor específico del hierro es igual a 0,113 cal/gramo . grado. Hallar el peso atómico aproximado del hierro.
Aplicando la expresión derivada de la ley de Dulong y Petit se tiene
Peso atómico del hierro 55,7.
Carrera: Ing. Civil.
Seccion: I-003
Alumno: Leandro Quiroz
joel pereira I005 petroquimica -
La masa molecular es la suma de las masas atómicas (en 'uma' o simplemente 'u') en una molécula. En algunos textos todavía se denomina como 'peso molecular' a la 'masa molecular'.
Para calcularla debemos saber las masas atómicas de cada uno de los elementos que intervienen en el compuesto.
Empezaremos por uno de los lados de la fórmula, por ejemplo el izquierdo.
Multiplicaremos el subíndice del elemento (cuando no existe se asume que es 1) por la masa atómica del mismo.
Procederemos de la misma forma con todos los elementos.
Sumaremos los resultados de todas las multiplicaciones y de esta forma tendremos la masa molecular expresada en unidades de masa atómica ('uma' o 'u')que es (unidades de masa molecular)
H2SO4
datos:
MM hidregeno= 1u
MM asufre = 32u
MM oxigeno = 16u
numero de moleculas que los acompañan
para el:
hidrogeno 2
asufre 1
oxigeno 4
ahora se multiplica como ya mencionada el numero de moleculas por el peso atomico.
H= 1x2 = 2u
S= 32x1 = 32u
O= 16x4 = 64u se suma y es un total de: 98u de acido sulfurico
dionna medina -
Masa de una molécula de un compuesto. Se obtiene sum Como éstas son sumamente pequeñas, se recurrió al procedimiento de determinar su masa relativa. O lo que es equivalente, encontrar cuán pesado era un átomo de un elemento comparado con un átomo de otro elemento. Para esto, habría que tomar los átomos de un determinado elemento como patrón de referencia,ando las masas atómicas de los elementos químicos que entran en la fórmula molecular del compuesto.
Supongamos que queremos averiguar cuál es la masa molecular del agua. Sabemos que su fórmula química es H2O, es decir, que está compuesta por dos átomos de Hidrógeno y uno de Oxígeno. Por otro lado sabemos que:
Masa atómica del Hidrógeno: MH = 1 uma
Masa atómica del Oxígeno: MO = 16 uma
Luego la masa molecular del agua, MH2O, será:
MH2O = 2 × MH + MO = 2 × 1 uma + 16 uma = 18 uma
Estos valores son los que están incluidos en una tabla periódica estándar, y es lo que es más usado para los cálculos ordinarios.número entero sencillo. Si se determina el peso molar de los compuestos de. un elemento y, por análisis, se averigua la cantidad de elemento que existe en dichos pesos molares, las cantidades halladas son múltiplos sencillos del peso atómico gramo correspondiente (peso atómico expresado en gramos) y, por consiguiente, este peso atómico será, muy probablemente, el máximo común divisor de todas aquellas cantidades.
número entero sencillo. Si se determina el peso molar de los compuestos de. un elemento y, por análisis, se averigua la cantidad de elemento que existe en dichos pesos molares, las cantidades halladas son múltiplos sencillos del peso atómico gramo correspondiente (peso atómico expresado en gramos) y, por consiguiente, este peso atómico será, muy probablemente, el máximo común divisor de todas aquellas cantidades.
tomamos los pesos atómicos de los elementos que lo componen y multiplicamos cada peso atómico por el subíndice que corresponde al elemento según la fórmula molecular.....
mayra roa CI21628070 carrera ing petroquimica seccion I005D -
El peso atómico estándar se refiere a la media de las masas atómicas relativas de un elemento en el medio local de la corteza terrestre y la atmósfera terrestre, como está determinado por la Commission on Atomic Weights and Isotopic Abundances (Comisión de Pesos Atómicos y Abundancias Isotópicas) de la IUPAC.2 Estos valores son los que están incluidos en una tabla periódica estándar, y es lo que es más usado para los cálculos ordinarios. Se incluye una incertidumbre en paréntesis que frecuentemente refleja la variabilidad natural en la distribución isotópica, en vez de la incertidumbre en la medida.3 Para los elementos sintéticos, el isótopo formado depende de los medios de síntesis, por lo que el concepto de abundancia isotópica natural no tiene sentido. En consecuencia, para elementos sintéticos, el conteo total de nucleones del isótopo más estable (esto es, el isótopo con la vida media más larga) está listado en paréntesis en el lugar del peso atómico estándar. El litio representa un caso único, donde la abundancia natural de los isótopos ha sido perturbada por las actividades humanas al punto de afectar la incertidumbre en su peso atómico estándar, incluso en muestras obtenidas de fuentes naturales, como los ríos.
La masa atómica relativa es un sinónimo para peso atómico y está cercanamente relacionado a masa atómica promedio (pero no es un sinónimo de masa atómica), la media ponderada de las masas atómicas de todos los átomos de un elemento químico encontrados en una muestra particular, ponderados por abundancia isotópica.4 Esto es usado frecuentemente como sinónimo para peso atómico relativo, y no es incorrecto hacer así, dado que los pesos atómicos estándar son masas atómicas relativas, aunque es menos específico. La masa atómica relativa también se refiere a ambientes no terrestres y ambientes terrestres altamente específicos que se desvían de la media o tienen diferentes certidumbres (número de cifras significativas) que los pesos atómicos estándar.
La masa isotópica relativa es la masa relativa de un isótopo dado (más específica, cualquier núclido solo), escalado con el carbono-12 como exactamente 12. No hay otros núclidos distintos al carbono-12 que tengan exactamente un número entero de masas en esta escala. Esto es debido a dos factores: [1] la diferente masa de neutrones y protones que actúan para cambiar la masa total en los núclidos con ratios protón/neutrón distintos al ratio 1:1 del carbono-12; y [2] no se encontrará un número exacto si existe una pérdida/ganancia de masa diferente a la energía de enlace nuclear relativa a la energía de enlace nuclear media del carbono-12. Sin embargo, puesto que cualquier defecto de masa debido a la energía de enlace nuclear es una fracción pequeña (menos del 1%) comparada con la masa de un nucleón (incluso menos comparado con la masa media por nucleón en el carbono-12, que está moderada a fuertemente unido), y dado que los protones y neutrones difieren en masa unos de otros por una fracción pequeña (aproximadamente 0,0014 uma, la práctica de redondear la masa atómica de cualquier núclido dado o isótopo al número entero más cercano, siempre da el número entero simple del conteo total de nucleones. El conteo de neutrones puede ser derivado por sustracción del número atómico.
Ejm: Calcule el peso o masa molecular del H2SO4 (Acido Sulfurico)
entonces: 2H: 2*1=2
S: 32*1=32
4O: 4*16=64
todo esto es igual a: 98g/mol que es el peso molecular del acido sulfurico.
rosimar oropeza CI 21097560 carrera ing petroquimica seccion I005D -
La formula para calcular es: % elemento X= [(núm. átomos de X)Ar(X)/Mr]100%
La masa molecular se calcula sumando las masas atómicas de los elementos que componen la molécula
En el caso de la molécula de agua, H2O, su masa molecular sería:
(masa atómica del H: 1,0079, masa atómica del O: 15,99994)
(Se multiplica por 2, ya que ésa es la cantidad de veces que el elemento H está presente en la molécula.)
ej: hierro:4d
La masa molar de una sustancia coincide numéricamente con la masa molecular, aunque son cosas distintas.
A pesar de que se sigue diciendo popularmente peso molecular, el término correcto es masa molecular.
Si se necesita la masa molecular de varios componentes, se multiplican por separado los átomos de cada componentes y se multiplican por la masa atómica. Luego se suman los dos. Vamos a determinar, por ejemplo, la masa molecular del componente C3H8:
Elemento = Átomos * Peso atómico
C= 3 * 12 = 36
H= 8 * 1 = 8
En los postulados de la teoría atómica Dalton establece que los átomos de los distintos elementos tienen masas diferentes. Por otra parte, lo que ocurre en las reacciones químicas es una interacción de átomos, por lo que las sustancias no reaccionan entre sí gramo a gramo y resulta necesario conocer las masas de aquellos. Como éstas son sumamente pequeñas, se recurrió al procedimiento de determinar su masa relativa. O lo que es equivalente, encontrar cuán pesado era un átomo de un elemento comparado con un átomo de otro elemento. Para esto, habría que tomar los átomos de un determinado elemento como patrón de referencia, patrón que sería elegido arbitrariamente. El número resultante de la comparación de los pesos respectivos de esos dos átomos es lo que se denominó peso atómico.
expresión que da el valor del peso molar de la sustancia en función de su densidad absoluta como gas en cualesquiera condiciones de presión y temperatura.
La aplicación de estas ecuaciones derivadas de la ecuación de estado al cálculo de pesos moleculares de gases o de substancias que pueden pasar fácilmente al estado gaseoso o bien a la determinación de alguna otra magnitud referente a una masa de gas, queda de manifiesto en los los ejemplos siguientes; el primero es el resuelto anteriormente mediante varios pasos sucesivos.
EJEMPLO. A 21 ºC y 742mm, O,583g de cloro ocupan un volumen de 203cm3. Calcular el peso molecular del cloro.
El cálculo se reduce simplemente a sustituir valores e. la expresión teniendo en cuenta que la presión debe estar expresada en atmósferas y el volumen en litros puesto que la constante R viene dada en atmósferas por litros partido de grado Kelvin y mol. Se tiene
Si se necesita la masa molecular de varios componentes, se multiplican por separado los átomos de cada componentes y se multiplican por la masa atómica. Luego se suman los dos. Vamos a determinar, por ejemplo, la masa molecular del componente C3H8:
Elemento = Átomos * Peso atómico
C= 3 * 12 = 36
H= 8 * 1 = 8
pedro lopez ci:22518611 2do semestre de ing petroquimica -
La formula para calcular es: % elemento X= [(núm. átomos de X)·Ar(X)/Mr]·100%
La masa molecular se calcula sumando las masas atómicas de los elementos que componen la molécula
En el caso de la molécula de agua, H2O, su masa molecular sería:
(masa atómica del H: 1,0079, masa atómica del O: 15,99994)
(Se multiplica por 2, ya que ésa es la cantidad de veces que el elemento H está presente en la molécula.)
ej: hierro:4d
La masa molar de una sustancia coincide numéricamente con la masa molecular, aunque son cosas distintas.
A pesar de que se sigue diciendo popularmente peso molecular, el término correcto es masa molecular.
Si se necesita la masa molecular de varios componentes, se multiplican por separado los átomos de cada componentes y se multiplican por la masa atómica. Luego se suman los dos. Vamos a determinar, por ejemplo, la masa molecular del componente C3H8:
Elemento = Átomos * Peso atómico
C= 3 * 12 = 36
H= 8 * 1 = 8
maria alejandra urbina I003D Ing. Civil 2 Semestre -
Los coeficientes de una ecuación ajustada representan:
* el número relativo de moléculas que participan en una reacción
* el número relativo de moles participantes en dicha reacción.
Por ejemplo en la ecuación ajustada siguiente:
la producción de dos moles de agua requieren el consumo de 2 moles de H2 un mol de O2.
Por lo tanto, en esta reacción tenemos que: "2 moles de H2, 1 mol de O2 y 2 moles de H2O" son cantidades estequiométricamente equivalentes.
Estas relaciones estequiométricas, derivadas de las ecuaciones ajustadas, pueden usarse para determinar las cantidades esperadas de productos para una cantidad dada de reactivos.
Ejemplo:
¿Cuántas moles de H2O se producirán en una reacción donde tenemos 1,57 moles de O2, suponiendo que tenemos hidrógeno de sobra?
El cociente:
es la relación estequiométrica entre el H2O y el O2 de la ecuación ajustada de esta reacción.
Ejemplo:
Calcula la masa de CO2 producida al quemar 1,00 gramo de C4H10.
Para la reacción de combustión del butano (C4H10) la ecuación ajustada es:
Para ello antes que nada debemos calcular cuantas moles de butano tenemos en 100 gramos de la muestra:
de manera que, si la relación estequiométrica entre el C4H10 y el CO2 es:
por lo tanto:
Pero la pregunta pedía la determinación de la masa de CO2 producida, por ello debemos convertir los moles de CO2 en gramos (usando el peso molecular del CO2):
De manera similar podemos determinar la masa de agua producida, la masa de oxígeno consumida, etc.
luis arvelo Ing. Petroquimica I-005 2do semestre -
La formula para calcular es: % elemento X= [(núm. átomos de X)·Ar(X)/Mr]·100%
La masa molecular se calcula sumando las masas atómicas de los elementos que componen la molécula
En el caso de la molécula de agua, H2O, su masa molecular sería:
(masa atómica del H: 1,0079, masa atómica del O: 15,99994)
(Se multiplica por 2, ya que ésa es la cantidad de veces que el elemento H está presente en la molécula.)
ej: hierro:4d
La masa molar de una sustancia coincide numéricamente con la masa molecular, aunque son cosas distintas.
Masa molecular= 44 g/mol
A pesar de que se sigue diciendo popularmente peso molecular, el término correcto es masa molecular.
Si se necesita la masa molecular de varios componentes, se multiplican por separado los átomos de cada componentes y se multiplican por la masa atómica. Luego se suman los dos. Vamos a determinar, por ejemplo, la masa molecular del componente C3H8:
Elemento = Átomos * Peso atómico
C= 3 * 12 = 36
H= 8 * 1 = 8
Nataly Buinitzky Ing Petroquímica 005. 2do Semestre -
El cálculo del peso molecular es sencillo. Tomamos la fórmula molecular de un compuesto, tomamos los pesos atómicos de los elementos que lo componen y multiplicamos cada peso atómico por el subíndice que corresponde al elemento según la fórmula molecular.
Ejm: Calcule el peso o masa molecular del H2SO4 (Acido Sulfurico)
entonces: 2H: 2*1=2
S: 32*1=32
4O: 4*16=64
todo esto es igual a: 98g/mol que es el peso molecular del acido sulfurico.
el término "peso molecular" debido a su uso extendido, el cientificamente correcto es "masa molecular". El peso es una fuerza, es decir una cantidad vectorial que posee módulo, dirección y sentido y depende del campo gravitacional en el que se encuentre inmerso. La masa, en cambio es un escalar y es independiente del campo gravitacional. Si la misma se expresa sin unidades se denomina "masa molecular relativa", mientras que si la unidad es "g/mol" recibe el nombre de "masa molar".
La masa molecular relativa es un número que indica cuántas veces mayor es la masa de una molécula de una sustancia con respecto a la unidad de masa atómica. Se determina sumando las masas atómicas relativas de los elementos cuyos átomos constituyen una molécula de dicha sustancia.
La formula para calcular es: % elemento X= [(núm. átomos de X)·Ar(X)/Mr]·100%
La masa molecular se calcula sumando las masas atómicas de los elementos que componen la molécula
wiliams paez -
Metodo de calculo de las masa moleculares de los compuestos:
La masa molecular es la suma de las masas atómicas (en 'uma' o simplemente 'u') en una molécula. En algunos textos todavía se denomina como 'peso molecular' a la 'masa molecular'.
Para calcularla debemos saber las masas atómicas de cada uno de los elementos que intervienen en el compuesto.
Empezaremos por uno de los lados de la fórmula, por ejemplo
Multiplicaremos el subíndice del elemento (cuando no existe se asume que es 1) por la masa atómica del mismo.
Procederemos de la misma forma con todos los elementos.
Sumaremos los resultados de todas las multiplicaciones y de esta forma tendremos la masa molecular expresada en unidades de masa atómica ('uma' o 'u').
Ejemplo de cálculo de masas moleculares
Si la fórmula tiene un paréntesis, multiplicaremos cada uno de los subíndices que se encuentren dentro del paréntesis por el número que viene como subíndice del paréntesis.
Nombres que se le pueden dar a los compuestos:
Los principales compuestos químicos que existen en la actualidad son:
Óxidos básicos, que están formados por un metal y oxígeno.ejemplos, el óxido plúmbico,óxido de litio,.
Óxidos ácidos, formados por un no metal y oxígeno. ejemplos, óxido hipocloroso,óxido selenioso,.
Hidruros, que pueden ser tanto metálicos como no metálicos. Están compuestos por un elemento e hidrógeno.ejemplos, hidruro de aluminio, hidruro de sodio,.
Hidrácidos, son hidruros no metálicos que, cuando se disuelven en agua, adquieren carácter ácido. Por ejemplo, el ácido iodhídrico,.
Hidróxidos, compuestos formados por la reacción entre un óxido básico y el agua, que se caracterizan por presentar el grupo oxidrilo (OH). Por ejemplo, el hidróxido de sodio, o sosa cáustica.
Oxoácidos, compuestos obtenidos por la reacción de un óxido ácido y agua. Sus moléculas están formadas por hidrógeno, un no metal y oxígeno. Por ejemplo, ácido clórico.
Sales binarias, compuestos formados por un hidrácido más un hidróxido. Por ejemplo, el cloruro de sodio.
Oxisales, formadas por la reacción de un oxoácido y un hidróxido, como por ejemplo el hipoclorito de sodio.
JHON MONTOYA 2 DO SEMESTRE ING. PETROQUIMICA SECCION I-005 -
En un principio, se tomó el hidrógeno como patrón, por su cualidad de ser el elemento más ligero, y se le adjudicó también arbitrariamente el peso unidad. A la masa correspondiente se la denominó «unidad atómicá de masa» (uam) y también «dalton».
La realización de estas primeras medidas tuvo como base teórica lá hipótesis de Avogadro: como dos volúmenes iguales de gases distintos -en iguales condiciones de presión y temperatura- contienen el mismo número de moléculas, la relación de pesos de esos dos volúmenes dará la relación de pesos de sus moléculas respectivas. Así, por ejemplo, como un volumen de oxígeno (O2) pesa 16 veces más que el mismo volumen de hidrógeno (H2), a igualdad de presión y temperatura, el peso de una molécula de O2 es 16 veces mayor que el de una molécula de H2. Se obtuvo así una escala de pesos moleculares y de ella una de pesos atómicos. (Actualmente, las masas atómicas relativas se determinan con enorme precisión en el aparato denominado espectrómetro de masas).
Debido al difícil manejo del hidrógeno y, sobre todo, a que con él se obtenían pesos moleculares no enteros para muchos gases, se adoptó como nuevo patrón al oxígeno en lugar del hidrógeno. Al átomo de oxígeno se le asignó, también arbitrariamente, una masa atómica de 16 uam. En la actualidad y desde 1961, para unificar criterios, la IUPAC (International Union 0f Pure and Applied Chemistry) acordó utilizar un nuevo patrón: el isótopo del carbono de número másico 12 (que se representa como C12 ó como C-12), al que se le adjudicó la masa atómica exacta de 12 uam. (Isótopos son átomos de un mismo elemento que sólo difieren en su masa. Los elementos se presentan en la naturaleza como mezclas de varios isótopos).
De esta manera, el que el cloro tenga, por ejemplo, un peso atómico de 35,5, significa que sus átomos son 35,5 veces más pesados que 1/12 del átomo de C12.
En definitiva, hay que considerar que:
a) El peso atómico de un elemento es un peso relativo, comparado con el peso de un átomo de C-12.
b) El peso atómico de un elemento es, en realidad, el peso atómico medio de todos los isótopos de ese elemento, teniendo en cuenta la cantidad relativa de cada isótopo, tal como se presenta dicho elemento en la naturaleza (abundancia relativa)
c) En compuestos, habremos de referirnos a pesos moleculares, suma de los pesos atómicos de todos los átomos que constituyen su molécula.
Aunque los términos de peso atómico y molecular están muy extendidos, es más correcto hablar de masa atómica y molecular, ya que el peso deriva de la masa, necesitando la acción de un campo gravitatorio para su puesta en evidencia. Sin embargo, tradicionalmente se suele utilizar el término de peso atómico para designar la masa atómica media de un elemento teniendo en cuenta sus isótopos, y el de masa atómica para designar la masa de los átomos de cada isótopo de un elemento. Esta es la terminología más extendida que se utiliza. Los pesos atómicos de todos los elementos conocidos se encuentran recogidos en la actualidad en la Tabla Periódica.
Determinación de masas moleculares de gases.
Método de densidades relativas.
El Principio de Avogadro (página 42), al establecer que en un volumen dado gaseoso, medido siempre en las mismas condiciones de presión y temperatura, existe un número invariable de moléculas cualquiera que sea el gas contenido, permite conocer el peso molecular relativo de ellas puesto que la relación en peso de dos de dichos volúmenes, esto es, la densidad relativa de un gas respecto al otro, ha de ser igual a la relación entre el peso de sus moléculas. Esto es,
y como la primera relación es la densidad relativa del gas A respecto del B, expresada por DA (B), y en la segunda relación puede cancelarse el factor común n, número igual de moléculas en los dos gases, resulta
o sea, Peso molecular del gas = Peso molecular del gas B x DA (B)
Si se conociese el peso de una molécula de una sustancia gaseosa cualquiera podría hallarse el peso molecular de cualquier otro gas con sólo determinar la densidad relativa de éste respecto al primero. Si tomamos como referencia la masa molecular del oxígeno (32,000) obtenemos:
Pesó molecular gas A = 32,000 x DA (Oxígeno)
Método de densidades absolutas
Partiendo de la forma general de la ecuación de estado de los gases ideales, PV = nRT, se pueden obtener las masas moleculares de las sustancias gaseosas o fácilmente volátiles.
El número de moles n, en un volumen de gas viene dado por a/M siendo a el número de gramos de la sustancia gaseosa y M su masa molar. En consecuencia, la ecuación general de los gases toma la forma
expresión esta última que da el peso molar de la sustancia en función de magnitudes directamente determinables.
Puesto que a / V es la densidad absoluta del gas en las condiciones experimentales de presión y temperatura, se tiene,
expresión que da el valor del peso molar de la sustancia en función de su densidad absoluta como gas en cualesquiera condiciones de presión y temperatura.
La aplicación de estas ecuaciones derivadas de la ecuación de estado al cálculo de pesos moleculares de gases o de substancias que pueden pasar fácilmente al estado gaseoso o bien a la determinación de alguna otra magnitud referente a una masa de gas, queda de manifiesto en los los ejemplos siguientes; el primero es el resuelto anteriormente mediante varios pasos sucesivos.
EJEMPLO. A 21 ºC y 742mm, O,583g de cloro ocupan un volumen de 203cm3. Calcular el peso molecular del cloro.
El cálculo se reduce simplemente a sustituir valores e. la expresión teniendo en cuenta que la presión debe estar expresada en atmósferas y el volumen en litros puesto que la constante R viene dada en atmósferas por litros partido de grado Kelvin y mol. Se tiene
Por consiguiente, el peso molecular del cloro es 70,9
EJEMPLO. Calcular la cantidad de vapor de agua que hay en el aire de una habitación cuyas dimensiones son 5,10 m de larga, 4,30 m de ancha Y 3,20 m de alta, si la humedad relativa es del 70% y la temperatura ambiente es de 23.ºC La presión de vapor del agua a 23 ºC es 21,07 mm y un mol de agua pesa 18,016 gramos.
El vapor de agua ocupa el volumen de la habitación iguaI a 5,10 x 4,30 x 3,2 m3 o sea 70,18 m3 equivalentes a 70180 litros, Y su presión gaseosa, presión parcial en el aire, es el 70% de 21,07 mm, o sea I4,75 milímetros.
En la expresión despejaremos el valor de a y substituiremos los demás por sus magnitudes conocidas. Se tiene
Cuando los gases discrepan mucho del comportamiento ideal, tal como a grandes presiones y bajas temperaturas, debe aplicarse la ecuación de van der Waals
en la que V es el volumen molar y a y b las correspondientes constantes.
Determinación de masas atómicas
Método de Cannizzaro
Masas atómicas aproximadas. ley de Dulong y Petit.
Método de Cannizzaro
La determinación del peso molecular de los compuestos de un elemento dado permite hallar fácilmente su peso atómico. Puesto que los átomos son indivisibles, en una molécula hay, necesariamente, un número entero de átomos de cada clase y, casi siempre, un número entero sencillo. Si se determina el peso molar de los compuestos de. un elemento y, por análisis, se averigua la cantidad de elemento que existe en dichos pesos molares, las cantidades halladas son múltiplos sencillos del peso atómico gramo correspondiente (peso atómico expresado en gramos) y, por consiguiente, este peso atómico será, muy probablemente, el máximo común divisor de todas aquellas cantidades. El método se debe a CANNIZZARO por ser este químico el primero que reconoció la significación del Principio de Avogadro y su aplicación a la determinación de pesos moleculares y atómicos. También se conoce como método del máximo común divisor.
El siguiente cuadro tabula los datos experimentales y calculados conducentes a la determinación del peso atómico - del cloro, el cual resulta igual a 35,5. Este valor es aproximado por serlo también los pesos moleculares encontrados de los correspondientes compuestos.
Masas atómicas aproximadas. ley de Dulong y Petit.
El método de Cannizzaro no puede utilizarse para la determinación del peso atómico de los elementos metálicos puesto que, en general, estos elementos no forman compuestos volátiles. Afortunadamente pudo encontrarse una relación entre el peso atómico y su calor especifico al observar DULONG y PETIT que el producto del calor específico de cualquier elemento sólido por su peso atómico es prácticamente constante e igual a 6,3.
Puesto que el calor específico es la cantidad de calor necesaria para elevar en un grado centígrado la temperatura de un gramo del cuerpo, este producto corresponde a la capacidad calorífica de un mol.
La ley de Dulong y Petit puede enunciarse en la forma siguiente:
Los calores atómicos de los elementos en estado sólido son prácticamente iguales a 6,3.
(Dimensionalmente, este valor viene expresado en cal/ºC. mol.) Por consiguiente,
Calor específico x Peso atómico = 6,3 o sea, Peso atómico = 6,3 / Calor específico
La ley de Dulong y Petit no es muy exacta y además no puede aplicarse a elementos de peso atómico bajo tal como el berilio, boro, carbono y silicio para los cuales el calor atómico es excepcionalmente muy bajo.
EJEMPLO. El calor específico del hierro es igual a 0,113 cal/gramo . grado. Hallar el peso atómico aproximado del hierro.
Aplicando la expresión derivada de la ley de Dulong y Petit se tiene
Peso atómico del hierro 55,7.
La masa molecular se calcula sumando las masas atómicas de los elementos que componen la molécula
En el caso de la molécula de agua, H2O, su masa molecular sería:
(masa atómica del H: 1,0079, masa atómica del O: 15,99994)
(Se multiplica por 2, ya que ésa es la cantidad de veces que el elemento H está presente en la molécula.)
ej: hierro:4d
La masa molar de una sustancia coincide numéricamente con la masa molecular, aunque son cosas distintas.
A pesar de que se sigue diciendo popularmente peso molecular, el término correcto es masa molecular.
Si se necesita la masa molecular de varios componentes, se multiplican por separado los átomos de cada componentes y se multiplican por la masa atómica. Luego se suman los dos. Vamos a determinar, por ejemplo, la masa molecular del componente C3H8:
Elemento = Átomos * Peso atómico
C= 3 * 12 = 36
H= 8 * 1 = 8