Anuncios sobre Laboratorio y Evaluaciones
Buenas Tardes!!!
Estuve observando sus comentarios acerca de la actividad propuesta, y ya estoy calificándolas... Mientras tanto, les comento que ya está el cronograma de prácticas de laboratorio, del cual les estoy ofreciendo una copia digital en mi espacio público de MSN, en: http://cid-f5e16d6b27fde625.skydrive.live.com/browse.aspx/P%C3%BAblico/Semestre%202-2009%20%5E5Qu%C3%ADmica%20General%5E6?sa=512688352, al igual que el plan de evaluación conjunto para ambas secciones, con las fechas propuestas de las evaluaciones.
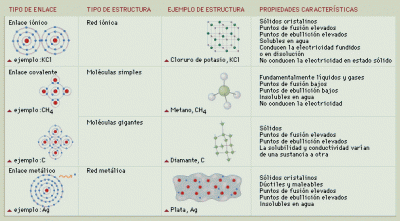
Recuerden que el día Martes 27 de Octubre es nuestro primer Parcial, por lo cual les recomiendo revisen la página de Wikipedia http://es.wikipedia.org/wiki/Enlace_qu%C3%ADmico, donde se habla, no solo de los enlaces ya comentados, sino de muchos otros tipos de enlaces, y en http://www.visionlearning.com/library/module_viewer.php?mid=55&l=s, pueden encontrar ejemplos e incluso recreaciones de los tipos de enlaces comentados en clase... Un documento interesante se puede encontrar en http://www.monografias.com/trabajos7/enqui/enqui.shtml, donde se amplía la explicación discutida...
Como actividad de esta semana, les voy a solicitar que comenten acerca de las diferentes características de los tipos de enlaces (iónico y covalente) en los compuestos de uso cotidiano, por ejemplo la sal común o Cloruro de Sodio ó la cal viva u Óxido de Calcio, y cómo influyen en sus características específicas...
Saludos!!!
32 comentarios
paolix oropeza Ci:20055094 ing civil I-003 -
El hidrógeno es un elemento químico representado por el símbolo H y con un número atómico de 1. En condiciones normales de presión y temperatura, es un gas diatómico (H2) incoloro, inodoro, insípido, no metálico y altamente inflamable. Con una masa atómica de 1,00794(7) u, el hidrógeno es el elemento químico más ligero y es, también, el elemento más abundante, constituyendo aproximadamente el 75% de la materia visible del universo.
El oxígeno es un elemento químico de número atómico 8 y símbolo O. En su forma
molecular más frecuente, O2, es un gas a temperatura ambiente. Representa aproximadamente el 20,9% en volumen de la composición de la atmósfera terrestre. Es uno de los elementos más importantes de la química orgánica y participa de forma muy importante en el ciclo energético de los seres vivos, esencial en la respiración celular de los organismos aeróbicos. Es un gas incoloro, inodoro (sin olor) e insípido. Existe una forma molecular formada por tres átomos de oxígeno, O3, denominada ozono cuya presencia en la atmósfera protege la Tierra de la incidencia de radiación ultravioleta procedente del Sol.
Se denomina química (del egipcio kēme (kem), que significa "tierra") a la ciencia que estudia la composición, estructura y propiedades de la materia, como los cambios que ésta experimenta durante las reacciones químicas y su relación con la energía.
Las disciplinas de la química han sido agrupadas por la clase de materia bajo estudio o el tipo de estudio realizado. Entre éstas se tienen la química inorgánica, que estudia la materia inorgánica; la química orgánica, que trata con la materia orgánica; la bioquímica, el estudio de substancias en organismos biológicos; la físico-química, comprende los aspectos energéticos de sistemas químicos a escalas macroscópicas, moleculares y atómicas; la química analítica, que analiza muestras de materia tratando de entender su composición y estructura
La ubicuidad de la química en las ciencias naturales hace que sea considerada como una de las ciencias básicas. La química es de gran importancia en muchos campos del conocimiento, como la ciencia de materiales, la biología, la farmacia, la medicina, la geología, la ingeniería y la astronomía, entre otros.
Los procesos naturales estudiados por la química involucran partículas fundamentales (electrones, protones y neutrones), partículas compuestas,núcleos atómicos, átomos y moléculas) o estructuras microscópicas como cristales y superficies.
Los enlaces covalentes son las fuerzas que mantienen unidos entre sí los átomos no metálicos (los elementos situados a la derecha en la tabla periódica -C, O, F, Cl, ...).
Estos átomos tienen muchos electrones en su nivel más externo (electrones de valencia) y tienen tendencia a ganar electrones más que a cederlos, para adquirir la estabilidad de la estructura electrónica de gas noble. Por tanto, los átomos no metálicos no pueden cederse electrones entre sí para formar iones de signo opuesto
Tipos de enlace covalente
Existen dos tipos de sustancias covalentes:
Sustancias covalentes moleculares: los enlaces covalentes forman moléculas. Tienen las siguientes propiedades:
Temperaturas de fusión y ebullición bajas.
En condiciones ordinales (25 ºC aprox.) pueden ser sólidos, líquidos o gaseosos
Son blandos en estado sólido.
Aislantes de corriente eléctrica y calor.
Redes: además las sustancias covalentes forman redes, semejantes a los compuestos iónicos. Tienen estas propiedades:
Elevadas temperaturas de fusión y ebullición.
Sólidos en condiciones ordinales.
Son sustancias muy duras (excepto el grafito).
Aislantes (excepto el grafito).
magdalena torres seccion 003 ing civil -
katherine Alvarado. seccion: II005D Ing-Petroquimica -
Este tipo de enlace se produce entre elementos muy electronegativos (no metales). Para que se dé unión La fuerza de atracción entre las cargas positivas de los núcleos y las cargas negativas de los electrones que se comparten.
Si los átomos que se unen con enlace covalente forman 'sólidos covalentes' y Están constituidas de moléculas; es decir, agrupaciones de un número concreto de átomos que se encuentran unidos dos a dos mediante enlace covalente. Se representa mediante la fórmula molecular.
Son las únicas sustancias que podemos considerar que tienen moléculas como tales entes que se pueden aislar.
En los enlaces iónicos Es el enlace que se da entre elementos de electronegatividades muy diferentes. Se produce una cesión de electrones del elemento menos electronegativo al mas electronegativo y se forman los respectivos iones positivos (los que pierden electrones) y negativos (los átomos que ganan los electrones).
Este tipo de enlace suele darse entre elementos que están a un extremo y otro de la tabla periódica. O sea, el enlace se produce entre elementos muy electronegativos (no metales) y elementos poco electronegativos (metales).
noguera francis ing. petroquimica 005 -
Algunas características de los compuestos formados por este tipo de enlace son:
* Son sólidos de estructura cristalina en el sistema cúbico.
* Este enlace se produce una transferencia de electrones de un metal a un no metal formando iones
* Altos puntos de fusión y ebullición.
* Son enlaces resultantes de la interacción entre los metales de los grupos I y II y los no metales de los grupos VI y VII.
* Son solubles en solventes polares y aun así su solubilidad es muy baja.
* Una vez fundidos o en solución acuosa, sí conducen la electricidad.
* En estado sólido no conducen la electricidad. Si utilizamos un bloque de sal como parte de un circuito en lugar del cable, el circuito no funcionará. Así tampoco funcionará una bombilla si utilizamos como parte de un circuito un cubo de agua, pero si disolvemos sal en abundancia en dicho cubo, la bombilla, del extraño circuito, se encenderá . Esto se debe a que los iones disueltos de la sal son capaces de acudir al polo opuesto (a su signo) de la pila del circuito y por ello este funciona.
Puentes Hidrógeno
La presencia de cargas parciales sobre los átomos de oxígeno e hidrógeno de la molécula del agua hace posible que entre ellas mismas se formen enlaces débiles debido a la atracción electrostática, llamados puentes de hidrógeno. Dada la estructura de la molécula de agua, se pueden formar hasta 4 puentes de H, dos a través del átomo de Oxígeno y uno por cada átomo de Hidrógeno.
Son interacciones polares y su intensidad es cerca de 5-10% de enlace covalente. En el enlace por puente de hidrógeno los tipos más importantes de fuerzas de atracción son débiles y estos enlaces son los causantes de que el agua sea un líquido a temperatura ambiente en lugar de un gas. Donde existe un hidrógeno unido a un elemento fuertemente electronegativo se establece una unión intermolecular, precisamente entre el H de una molécula y el elemento fuertemente negativo de la otra.
Este enlace se puede establecer además entre el agua y cualquier otra molécula. Si el puente se establece entre dos moléculas diferentes ya sea de la misma o de diferente especie se le denomina enlace intermolecular, por ejemplo la molécula de agua, el ácido fluorhídrico etc.
francis noguera ing. petroquimica 005 -
Por ejemplo, durante la reacción del sodio con el cloro: sodio (en la izquierda) pierde su única valencia de electrones al cloro (a la derecha),
resultando en un ión de sodio cargado positivamente (izquierda) y un ión de cloro cargado negativamente (derecha).
Imágenes de Visionlearning
Características del enlace iónico. Se rompe con facilidad obteniéndose los iones que lo forman, generalmente basta disolver la substancia.
Las substancias con enlaces iónicos son solubles en solventes polares.
Cloruro de sodio disuelto en H2O
Imagen de Visionlearning
Enlaces Covalentes
El segundo tipo de enlace atómico ocurre cuando los átomos comparten electrones. Al contrario de los enlaces iónicos en los cuales ocurre una transferencia completa de electrones, el enlace covalente ocurre cuando dos (o más) elementos comparten electrones. Esto ocurre comúnmente cuando dos no metales se enlazan. Ya que ninguno de los elementos que participan en el enlace querrán ganar electrones, estos elementos compartirán electrones para poder llenar sus envolturas de valencia.
La distribución de e- compartidos y no compartidos es lo que determina la estructura tridimensional de las moléculas
Un buen ejemplo de un enlace covalente es el que ocurre entre dos átomos de hidrógeno. Los átomos de hidrógeno (H) tienen un electrón de valencia en su primera capa. Puesto que la capacidad máxima de esta capa es de dos electrones, cada átomo de hidrógeno "querrá" tomar un segundo electrón. En un esfuerzo por conseguir un segundo electrón, el átomo de hidrógeno reaccionará con átomos H vecinos para formar el compuesto H2. De esta manera, ambos átomos comparten la estabilidad de una envoltura de valencia. Lo mismo ocurre con el oxígeno, solo que tiene un enlace doble, con 2 enlaces covalentes.
Enlaces Polares y No-Polares
En realidad, hay dos sub-tipos de enlaces covalentes. La molécula H2 es un buen ejemplo del primer tipo de enlace covalente: el enlace no polar. Ya que ambos átomos en la molécula H2 tienen una igual atracción (o afinidad) hacia los electrones, los electrones que se enlazan son igualmente compartidos por los dos átomos, y se forma un enlace covalente no polar. Siempre que dos átomos del mismo elemento se enlazan, se forma un enlace no polar . Los enlaces O-O y C-H son no polares.
Los enlaces covalentes son muy fuertes y su estabilidad poco se afecta por la presencia de solventes. Un ejemplo típico de enlace covalente es el enlace Carbono-Carbono que se presenta en gran número de compuestos orgánicos.
En la práctica, los orbitales compartidos no se encuentran repartidos de manera equivalente, ya que los átomos más electronegativos tienden a mantener a los electrones en su cercanía y, por lo tanto, el orbital molecular de enlace presenta mayor volumen en la vecindad del átomo electronegativo. Los enlaces covalentes en los que ambos átomos participantes poseen una electronegatividad semejante (como en los enlaces C-C), no presentan diferencias en la carga electrónica a lo largo de la molécula, por tanto su carga eléctrica es también uniforme y se dice que no poseen polaridad.
Un enlace polar se forma cuando los electrones son desigualmente compartidos entre dos átomos, o difieren en su electronegatividad (poder del átomo en una molécula para atraer electrones). Los enlaces covalentes polares ocurren porque un átomo tiene una mayor afinidad hacia los electrones que el otro (sin embargo, no tanta como para empujar completamente los electrones y formar un ión). En un enlace polar los electrones que se enlazan pasarán un mayor tiempo alrededor del átomo que tiene la mayor afinidad hacia los electrones. Un buen ejemplo del enlace polar covalente es el enlace H-O en la molécula de agua.
Sin embargo, en muchos casos el enlace covalente se forma entre átomos de distinta electronegatividad y en consecuencia los electrones se agrupan más cerca de aquel átomo electronegativo, como consecuencia un lado de la molécula es electrodeficiente (posee carga parcial positiva) y el otro es electrodenso (posee carga parcial negativa). Este tipo de enlaces se designan como enlaces covalentes polares y las moléculas con este desbalance de cargas se designan como dipolares.
H2O: una molécula de agua
Las moléculas de agua contienen dos átomos de hidrógeno (dibujados en rojo) enlazados a un átomo de oxígeno (en azul). El oxígeno, con seis electrones de valencia, necesita dos electrones adicionales para completar su envoltura de valencia. Cada hidrógeno contiene un electrón. Por consiguiente el oxígeno comparte los electrones de dos átomos de hidrógeno para completar su propia envoltura de valencia, y en cambio, comparte dos de sus propios electrones con cada hidrógeno, completando la envoltura de valencia H.
Características del enlace covalente. Es muy fuerte y se rompe con dificultad.
Si la diferencia de electronegatividades entre los 2 átomos es marcada, tenemos un enlace polar y se favorecerá la solubilidad de la sustancia en solventes polares. Ejemplo: un enlace O-H
Si la diferencia de electronegatividad es poca, tenemos un enlace no polar y se favorecerá la solubilidad de la sustancia en solventes no polares. Ejemplo: un enlace C-H o C-C.
Puentes Hidrógeno
La presencia de cargas parciales sobre los átomos de oxígeno e hidrógeno de la molécula del agua hace posible que entre ellas mismas se formen enlaces débiles debido a la atracción electrostática, llamados puentes de hidrógeno. Dada la estructura de la molécula de agua, se pueden formar hasta 4 puentes de H, dos a través del átomo de Oxígeno y uno por cada átomo de Hidrógeno.
Son interacciones polares y su intensidad es cerca de 5-10% de enlace covalente. En el enlace por puente de hidrógeno los tipos más importantes de fuerzas de atracción son débiles y estos enlaces son los causantes de que el agua sea un líquido a temperatura ambiente en lugar de un gas. Donde existe un hidrógeno unido a un elemento fuertemente electronegativo se establece una unión intermolecular, precisamente entre el H de una molécula y el elemento fuertemente negativo de la otra.
Este enlace se puede establecer además entre el agua y cualquier otra molécula. Si el puente se establece entre dos moléculas diferentes ya sea de la misma o de diferente especie se le denomina enlace intermolecular, por ejemplo la molécula de agua, el ácido fluorhídrico etc.
joel pereira petroquimica I 005 -
Na Cl → Na + Cl-
De esta manera se forman dos iones de carga contraria: un catión (de carga positiva) y un anión (de carga negativa). La diferencia entre las cargas de los iones provoca entonces una fuerza de interacción electromagnética entre los átomos que los mantiene unidos. El enlace iónico es la unión en la que los elementos involucrados aceptarán o perderán electrones.
En la solución, los enlaces iónicos pueden romperse y se considera entonces que los iones están disociados. Es por eso que una solución fisiológica de cloruro de sodio y agua se marca como "Na+ + Cl-" mientras que los cristales de cloruro de sodio se marcan "Na+Cl-" o simplemente "NaCl".
caracteristicas.....
Algunas características de los compuestos formados por este tipo de enlace son:
Son sólidos de estructura cristalina en el sistema cúbico.
Este enlace se produce una transferencia de electrones de un metal a un no metal formando iones
Altos puntos de fusión y ebullición.
Son enlaces resultantes de la interacción entre los metales de los grupos I y II y los no metales de los grupos VI y VII.
Son solubles en solventes polares y aun así su solubilidad es muy baja.
Una vez fundidos o en solución acuosa, sí conducen la electricidad.
En estado sólido no conducen la electricidad. Si utilizamos un bloque de sal como parte de un circuito en lugar del cable, el circuito no funcionará. Así tampoco funcionará una bombilla si utilizamos como parte de un circuito un cubo de agua, pero si disolvemos sal en abundancia en dicho cubo, la bombilla, del extraño circuito, se encenderá . Esto se debe a que los iones disueltos de la sal son capaces de acudir al polo opuesto (a su signo) de la pila del circuito y por ello este funciona.
Enlaces Covalentes
El segundo tipo de enlace atómico ocurre cuando los átomos comparten electrones. Al contrario de los enlaces iónicos en los cuales ocurre una transferencia completa de electrones, el enlace covalente ocurre cuando dos (o más) elementos comparten electrones. Esto ocurre comúnmente cuando dos no metales se enlazan. Ya que ninguno de los elementos que participan en el enlace querrán ganar electrones, estos elementos compartirán electrones para poder llenar sus envolturas de valencia.
La distribución de e- compartidos y no compartidos es lo que determina la estructura tridimensional de las moléculas
Un buen ejemplo de un enlace covalente es el que ocurre entre dos átomos de hidrógeno. Los átomos de hidrógeno (H) tienen un electrón de valencia en su primera capa. Puesto que la capacidad máxima de esta capa es de dos electrones, cada átomo de hidrógeno "querrá" tomar un segundo electrón. En un esfuerzo por conseguir un segundo electrón, el átomo de hidrógeno reaccionará con átomos H vecinos para formar el compuesto H2. De esta manera, ambos átomos comparten la estabilidad de una envoltura de valencia. Lo mismo ocurre con el oxígeno, solo que tiene un enlace doble, con 2 enlaces covalentes.
jose vidal ing petroquimica seccion I 005 -
Un ejemplo de sustancia con enlace iónico es el cloruro sódico. En su formación tiene lugar la transferencia de un electrón del átomo de sodio al átomo de cloro. Las configuraciones electrónicas de estos elementos después del proceso de ionización son muy importantes, ya que lo dos han conseguido la configuración externa correspondiente a los gases nobles, ganando los átomos en estabilidad. Se produce una transferencia electrónica, cuyo déficit se cubre sobradamente con la energía que se libera al agruparse los iones formados en una red cristalina que, en el caso del cloruro sódico, es una red cúbica en la que en los vértices del paralelepípedo fundamental alternan iones Cl- y Na+. De esta forma cada ion Cl- queda rodeado de seis iones Na+ y recíprocamente. Se llama índice de coordinación al número de iones de signo contrario que rodean a uno determinado en una red cristalina. En el caso del NaCl, el índice de coordinación es 6 para ambos
El enlace iónico es un tipo de interacción electrostática entre átomos que tienen una gran diferencia de electronegatividad. No hay un valor preciso que distinga la ionicidad a partir de la diferencia de electronegatividad, pero una diferencia sobre 2.0 suele ser iónica, y una diferencia menor a 1.5 suele ser covalente.en palabras mas sencillas, un enlace ionico es aquel en el que los elementos involucrados aceptan o pierden electrones (se da entre un cation y un anion) o dicho de otra forma, es aquel en el que un elemento mas electronegativo atrae a los electrones de otro menos electronegativo4 El enlace iónico implica la separación en iones positivos y negativos. Las cargas iónicas suelen estar entre -3e a +3e.
El enlace covalente polar es intermedio en su carácter entre un enlace covalente y un enlace iónico. Los átomos enlazados de esta forma tienen carga eléctrica neutra, por lo que el enlace se puede llamar no polar.
Los enlaces covalentes pueden ser simples cuando se comparte un solo par de electrones, dobles al compartir dos pares de electrones, triples cuando comparten tres pares de electrones, o cuádruples cuando comparten cuatro pares de electrones.
Los enlaces covalentes no polares se forman entre átomos iguales, no hay variación en el número de oxidación. Los enlaces covalentes polares se forman con átomos distintos con gran diferencia de electronegatividades. La molécula es eléctricamente neutra, pero no existe simetría entre las cargas eléctricas originando la polaridad, un extremo se caracteriza por ser electropositivo y el otro electronegativo.
En otras palabras, el enlace covalente es la union entre atomos en donde se da un compartimiento de electrones, las atomos que forman este tipo de enlace son de caracter no metalico. las moleculas que se forman con atomos iguales (mononucleares) presentan un enlace covalente pero en donde la diferencia de electronegatividades es "0"
Teniendo presenta las teorías de los enlaces iónicos y covalentes, es posible deducir la valencia de un elemento cualquiera a partir de su configuración electrónica.
La electrovalencia, valencia en la formación de compuestos iónicos, es el número de electrones que el átomo tiene que ganar o perder para conseguir la configuración de los gases nobles.
La covalencia, número de enlaces covalentes que puede formar un átomo, es el número de electrones desapareados que tiene dicho átomo. Hay que tener presente que un átomo puede desaparecer sus electrones al máximo siempre que para ello no haya de pasar ningún electrón a un nivel energético superior.
reina gonzalez ioo5d petroquimica II semetre -
Na Cl → Na + Cl-
De esta manera se forman dos iones de carga contraria: un catión (de carga positiva) y un anión (de carga negativa). La diferencia entre las cargas de los iones provoca entonces una fuerza de interacción electromagnética entre los átomos que los mantiene unidos. El enlace iónico es la unión en la que los elementos involucrados aceptarán o perderán electrones.
En la solución, los enlaces iónicos pueden romperse y se considera entonces que los iones están disociados. Es por eso que una solución fisiológica de cloruro de sodio y agua se marca como "Na+ + Cl-" mientras que los cristales de cloruro de sodio se marcan "Na+Cl-" o simplemente "NaCl".
Algunas características de los compuestos formados por este tipo de enlace son:
Son sólidos de estructura cristalina en el sistema cúbico.
Este enlace se produce una transferencia de electrones de un metal a un no metal formando iones
Altos puntos de fusión y ebullición.
Son enlaces resultantes de la interacción entre los metales de los grupos I y II y los no metales de los grupos VI y VII.
Son solubles en solventes polares y aun así su solubilidad es muy baja.
Una vez fundidos o en solución acuosa, sí conducen la electricidad.
En estado sólido no conducen la electricidad. Si utilizamos un bloque de sal como parte de un circuito en lugar del cable, el circuito no funcionará. Así tampoco funcionará una bombilla si utilizamos como parte de un circuito un cubo de agua, pero si disolvemos sal en abundancia en dicho cubo, la bombilla, del extraño circuito, se encenderá . Esto se debe a que los iones disueltos de la sal son capaces de acudir al polo opuesto (a su signo) de la pila del circuito y por ello este funciona.
el enlace covalente
En química, las reacciones entre dos átomos no metales producen enlaces covalentes. Este tipo de enlace se produce cuando existe electronegatividad polar y se forma cuando la diferencia de electronegatividad no es suficientemente grande como para que se efectúe transferencia de electrones. De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular.
A diferencia de lo que pasa en un enlace iónico, en donde se produce la transferencia de electrones de un átomo a otro, en el enlace químico covalente, los electrones de enlace son compartidos por ambos átomos. En el enlace covalente, los dos átomos no metálicos comparten un electrón, es decir se unen por uno de sus electrones del último orbital, el cual depende del número atómico del átomo en cuestión.
Características del enlace covalente
Enlace sencillo: 2 electrones unidos fisicamente por los subniveles inferiores metricos
Enlace doble: se comparten dos pares de electrones.
Enlace triple: se comparten 3 pares de electrones.
Formado el enlace covalente coordinado es idéntico a los demás enlaces covalentes.
Se representa con una flecha " →
Enlace cuatruple: es la union de 4 o mas atomos
Yulay Acosta -
Seccion: I.005
Como influiria el conocimiento de la quimica general en su desarrollo profecional especialmente en su carrera:
la quimica general influira en mi carrera mucho como estudiante de ing petroquimica ya que la quimica es la ciencia que estudia la materia y transformaciones de la matria y es la parte fundamental de la carrera ya que me proporcionara muchos conocimientos en mi lugar de trabajo (empresa)...y me ayudara a fortalezer mis estudios quimicos de sustancias.
Joseluis figueira C.I.: 22.416.569 Ing.petroquimica Seccion: I-005 -
El metal dona/cede uno o más electrones formando un ion con carga positiva o cationes, con configuración electrónica estable. Estos electrones luego ingresan en el no metal, originando un ion cargado negativamente o anión, que también tiene configuración electrónica estable. La atracción electrostática entre los iones de carga opuesta causa que se unan y formen un enlace.
Los compuestos iónicos forman redes cristalinas constituidas por iones de carga opuesta unidos por fuerzas electrostáticas. Este tipo de atracción determina las propiedades observadas. Si la atracción electrostática es fuerte, se forman sólidos cristalinos de elevado punto de fusión e insolubles en agua; si la atracción es menor, como en el caso del NaCl, el punto de fusión también es menor y, en general, son solubles en agua e insolubles en líquidos apolares como el benceno
las reacciones entre dos átomos no metales producen enlaces covalentes. Este tipo de enlace se produce cuando existe electronegatividad polar y se forma cuando la diferencia de electronegatividad no es suficientemente grande como para que se efectúe transferencia de electrones. De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular.
A diferencia de lo que pasa en un enlace iónico, en donde se produce la transferencia de electrones de un átomo a otro, en el enlace químico covalente, los electrones de enlace son compartidos por ambos átomos. En el enlace covalente, los dos átomos no metálicos comparten un electrón, es decir se unen por uno de sus electrones del último orbital, el cual depende del número atómico del átomo en cuestión
maria gabriela jimenez -
cediéndole el metal los electrones necesarios para que el NO METAL sea estable (8 electrones en su último nivel)...
un enlace covalente es entre NO metales y comparten electrones.
En que el Enlace Iónico es un tipo de enlace químico que usualmente se realiza entre metales e iones de no metales (o iones poli atómicos como el amonio) a través de la atracción electrostática.
Y el Enlace Covalente son las reacciones entre dos átomos no metales producen y que producen enlaces covalentes.
enlace ionico: diferencia entre electronegatividades en los comprometidos en el enlace, la diferencia es mayor que 1.7.
ej: Na- F
0.9- 4.0
4.0-0.9= 3.1
3.1>1.7
enlace covalente: si la diferencia entre la electronegatividades es 0 en el enlace es puramente covalente.
ej: O - O
3.5-3.5= 0
como por ejemplo el dioxido de carbono:
se produce por diversos procesos por combustión u oxidación de materiales que contienen carbono como el carbón, la madera, el aceite o algunos alimentos por la fermentación de azucares
El carbono puede constituir más compuestos que ningún otro elemento porque los átomos de carbono tienen la capacidad de formar enlaces carbono-carbono sencillo, doble y triple y también de unirse entre sí formando cadenas o estructuras cíclicas. La rama de la química que estudia los compuestos del carbono es la química orgánica.
maria jimenez CI 19992369
Ing. petroquimica II-005
edinson cantor. seccion 03 ing. civil -
El metal dona/cede uno o m¨¢s electrones formando un ion con carga positiva o cationes, con configuraci¨®n electr¨®nica estable. Estos electrones luego ingresan en el no metal, originando un ion cargado negativamente o ani¨®n, que tambi¨¦n tiene configuraci¨®n electr¨®nica estable. La atracci¨®n electrost¨¢tica entre los iones de carga opuesta causa que se unan y formen un enlace.
Los compuestos i¨®nicos forman redes cristalinas constituidas por iones de carga opuesta unidos por fuerzas electrost¨¢ticas. Este tipo de atracci¨®n determina las propiedades observadas. Si la atracci¨®n electrost¨¢tica es fuerte, se forman s¨®lidos cristalinos de elevado punto de fusi¨®n e insolubles en agua; si la atracci¨®n es menor, como en el caso del NaCl, el punto de fusi¨®n tambi¨¦n es menor y, en general, son solubles en agua e insolubles en l¨ªquidos apolares como el benceno.
Definici¨®n [editar]Se denomina enlace i¨®nico al enlace qu¨ªmico de dos o m¨¢s ¨¢tomos cuando ¨¦stos tienen una diferencia de electronegatividad mayor a 1.7 . En una uni¨®n de dos ¨¢tomos por enlace i¨®nico, un electr¨®n abandona el ¨¢tomo menos electronegativo y pasa a formar parte de la nube electr¨®nica del m¨¢s electronegativo. El cloruro de sodio (la sal com¨²n) es un ejemplo de enlace i¨®nico: en ¨¦l se combinan sodio y cloro, perdiendo el primero un electr¨®n que es capturado por el segundo:)
Na Cl ¡ú Na + Cl-
De esta manera se forman dos iones de carga contraria: un cati¨®n (de carga positiva) y un ani¨®n (de carga negativa). La diferencia entre las cargas de los iones provoca entonces una fuerza de interacci¨®n electromagn¨¦tica entre los ¨¢tomos que los mantiene unidos. El enlace i¨®nico es la uni¨®n en la que los elementos involucrados aceptar¨¢n o perder¨¢n electrones.
En la soluci¨®n, los enlaces i¨®nicos pueden romperse y se considera entonces que los iones est¨¢n disociados. Es por eso que una soluci¨®n fisiol¨®gica de cloruro de sodio y agua se marca como "Na+ + Cl-" mientras que los cristales de cloruro de sodio se marcan "Na+Cl-" o simplemente "NaCl".
Yessica Flores Ing. Civil I-003 2do semestre -
El enlace iónico consiste en la atracción electrostática entre átomos con cargas eléctricas de signo contrario. Este tipo de enlace se establece entre átomos de elementos poco electronegativos con los de elementos muy electronegativos. Es necesario que uno de los elementos pueda ganar electrones y el otro perderlo, y como se ha dicho anteriormente este tipo de enlace se suele producir entre un no metal (electronegativo) y un metal (electropositivo).
Un ejemplo de sustancia con enlace iónico es el cloruro sódico. En su formación tiene lugar la transferencia de un electrón del átomo de sodio al átomo de cloro. Las configuraciones electrónicas de estos elementos después del proceso de ionización son muy importantes, ya que lo dos han conseguido la configuración externa correspondiente a los gases nobles, ganando los átomos en estabilidad. Se produce una transferencia electrónica, cuyo déficit se cubre sobradamente con la energía que se libera al agruparse los iones formados en una red cristalina que, en el caso del cloruro sódico, es una red cúbica en la que en los vértices del paralelepípedo fundamental alternan iones Cl- y Na+. De esta forma cada ion Cl- queda rodeado de seis iones Na+ y recíprocamente. Se llama índice de coordinación al número de iones de signo contrario que rodean a uno determinado en una red cristalina. En el caso del NaCl, el índice de coordinación es 6 para ambos
Características del enlace covalente:
*Enlace sencillo: 2 electrones unidos fisicamente por los subniveles inferiores metricos
*Enlace doble: se comparten dos pares de electrones.
* Enlace triple: se comparten 3 pares de electrones.
* Formado el enlace covalente coordinado es idéntico a los demás enlaces covalentes.
* Se representa con una flecha " →
* Enlace cuatruple: es la union de 4 o mas atomos
Enlace covalente
Lewis expuso la teoría de que todos los elementos tienen tendencia a conseguir configuración electrónica de gas noble (8 electrones en la última capa). Elementos situados a la derecha de la tabla periódica ( no metales ) consiguen dicha configuración por captura de electrones; elementos situados a la izquierda y en el centro de la tabla ( metales ), la consiguen por pérdida de electrones. De esta forma la combinación de un metal con un no metal se hace por enlace iónico; pero la combinación de no metales entre sí no puede tener lugar mediante este proceso de transferencia de electrones; por lo que Lewis supuso que debían compartirlos.
Algunas características de los compuestos formados por este tipo de enlace son:
* Son sólidos de estructura cristalina en el sistema cúbico.
* Este enlace se produce una transferencia de electrones de un metal a un no metal formando iones
* Altos puntos de fusión y ebullición.
* Son enlaces resultantes de la interacción entre los metales de los grupos I y II y los no metales de los grupos VI y VII.
* Son solubles en solventes polares y aun así su solubilidad es muy baja.
* Una vez fundidos o en solución acuosa, sí conducen la electricidad.
* En estado sólido no conducen la electricidad. Si utilizamos un bloque de sal como parte de un circuito en lugar del cable, el circuito no funcionará. Así tampoco funcionará una bombilla si utilizamos como parte de un circuito un cubo de agua, pero si disolvemos sal en abundancia en dicho cubo, la bombilla, del extraño circuito, se encenderá . Esto se debe a que los iones disueltos de la sal son capaces de acudir al polo opuesto (a su signo) de la pila del circuito y por ello este funciona.
milianyer Landaeta Ing.Civil 003 2 semestre -
*Enlace sencillo: 2 electrones unidos fisicamente por los subniveles inferiores metricos
Enlace doble: se comparten dos pares de electrones.
Enlace triple: se comparten 3 pares de electrones.
Formado el enlace covalente coordinado es idéntico a los demás enlaces covalentes.
Se representa con una flecha " →
Enlace cuatruple: es la union de 4 o mas atomos
Características del enlace ionico:
Algunas características de los compuestos formados por este tipo de enlace son:
Son sólidos de estructura cristalina en el sistema cúbico.
Este enlace se produce una transferencia de electrones de un metal a un no metal formando iones
Altos puntos de fusión y ebullición.
Son enlaces resultantes de la interacción entre los metales de los grupos I y II y los no metales de los grupos VI y VII.
Son solubles en solventes polares y aun así su solubilidad es muy baja.
Una vez fundidos o en solución acuosa, sí conducen la electricidad.
En estado sólido no conducen la electricidad.
Si utilizamos un bloque de sal como parte de un circuito en lugar del cable, el circuito no funcionará. Así tampoco funcionará una bombilla si utilizamos como parte de un circuito un cubo de agua, pero si disolvemos sal en abundancia en dicho cubo, la bombilla, del extraño circuito, se encenderá . Esto se debe a que los iones disueltos de la sal son capaces de acudir al polo opuesto (a su signo) de la pila del circuito y por ello este funciona.
Sal de litio
Para otros usos de este término, véase Litio.
Las sales de litio, en farmacología, se refiere al uso del ion Li+, como medicamento. Se usan un número de sales químicas de litio como estabilizador de estados anímicos alterados, en especial, el trastorno bipolar. También juegan un papel en el tratamiento de la depresión y en particular de la manía, tanto de modo agudo como de largo plazo. Como estabilizador anímico, el litio es probablemente más efectivo previniendo la manía que la depresión y es capaz de reducir el riesgo de suicidio.1 En la depresión por si sola (el trastorno unipolar), el litio se puede usar para aumentar el efecto de otros antidepresivos. El carbonato de litio (Li2CO3), es el más comunmente prescrito, mientras que el citrato de litio (Li3C6H5O7), el sulfato de litio (Li2SO4), ácido aspártico y el ácido orótico en sales de litio son algunas alternativas.
Una vez es ingerido, el litio se distribuye ampliamente en el sistema nervioso central donde interactúa con varios neurotransmisores y receptores celulares, disminuyendo la liberación de noradrenalina e incrementando la síntesis de serotonina
Electrolitos y transporte inónico
El litio tiene propiedades muy similares al sodio aunque por si solo no puede mantener el potencial de membrana como lo hace el sodio. Sin embargo, bajo condiciones experimentales es capaz de sustituir al sodio y reducir en cierto grado los procesos asociados al potencial de acción.
monica portela I003D Ing Civil -
Una vez formados los cationes y los aniones, se establecen entre ellos fuerzas de atracción electrostática, lo que conduce a la formación del enlace.
La atracción electrostática no se limita a un sólo ión, sino que cada uno de ellos se rodea del número máximo posible de iones de carga opuesta, formando una red cristalina iónica tridimensional. Los compuestos iónicos no forman moléculas independientes.
Bajo estas líneas tienes una representación de la red cristalina del cloruro sódico o sal común (NaCl). La representación de la derecha se gira arrastrando con el botón izquierdo del ratón, y se amplía y reduce con el botón derecho
Cuando se combinan átomos de elementos metálicos (de bajo potencial de ionización, por lo que es fácil arrancarles electrones) con átomos de elementos no metálicos (de alta afinidad electrónica, por lo que ganan electrones con facilidad) el camino que suelen seguir estos átomos para completar su última capa es que el átomo del metal pierde electrones y el del no metal los gane.
Esto es lo que ocurre cuando se combinan el sodio y el cloro. El sodio tiene un único electrón en su capa más externa, y lo pierde con facilidad. De este modo su capa más externa pasa a ser una capa completa. Por su parte, el cloro tiene siete electrones en su capa más externa y facilidad para ganar otro electrón. De esta forma completa su última capa de electrones. El electrón de la capa más externa del sodio es transferido a la capa más externa del sodio, quedando ambos con su capa más externa completa. En este momento el sodio tiene 11 protones en su núcleo y 10 electrones en su corteza, por lo que tiene una carga de +1, y lo representamos como Na+. El cloro tiene ahora 17 protones en su núcleo y 18 electrones en su corteza, por lo que tiene una carga de -1, y lo representamos como Cl-.
Enlace covalente
Los enlaces covalentes son las fuerzas que mantienen unidos entre sí los átomos no metálicos (los elementos situados a la derecha en la tabla periódica -C, O, F, Cl, ...).
Estos átomos tienen muchos electrones en su nivel más externo (electrones de valencia) y tienen tendencia a ganar electrones más que a cederlos, para adquirir la estabilidad de la estructura electrónica de gas noble. Por tanto, los átomos no metálicos no pueden cederse electrones entre sí para formar iones de signo opuesto.
En este caso el enlace se forma al compartir un par de electrones entre los dos átomos, uno procedente de cada átomo. El par de electrones compartido es común a los dos átomos y los mantiene unidos, de manera que ambos adquieren la estructura electrónica de gas noble. Se forman así habitualmente moléculas: pequeños grupos de átomos unidos entre sí por enlaces covalentes.
Ejemplo: El gas cloro está formado por moléculas, Cl2, en las que dos átomos de cloro se hallan unidos por un enlace covalente. En la siguiente simulación interactiva están representados 2 átomos de cloro con solo sus capas externas de electrones. Aproxima un átomo a otro con el ratón y observa lo que ocurre:
maria alejandra urbina I003D Ing. Civil 2 Semestre -
El segundo mayor tipo de enlace atómico ocurre cuando los átomos comparten electrones. Al contrario de los enlaces iónicos en los cuales ocurre una transferencia completa de electrones, el enlace covalente ocurre cuando dos (o más) elementos comparten electrones. El enlace covalente ocurre porque los átomos en el compuesto tienen una tendencia similar hacia los electrones (generalmente para ganar electrones). Esto ocurre comúnmente cuando dos no metales se enlazan. Ya que ninguno de los no elementos que participan en el enlace querrán ganar electrones, estos elementos compartirán electrones para poder llenar sus envolturas de valencia. Un buen ejemplo de un enlace covalente es ese que ocurre entre dos átomos de hidrógeno. Los átomos de hidrógeno (H) tiene un electrón de valencia en su primera envoltura. Puesto que la capacidad de esta envolutura es de dos electrones, cada átomo hidrógeno 'querrá' recoger un segundo electrón. En un esfuerzo por recoger un segundo electrón, el átomo de hidrógeno reaccionará con átomos H vecinos para formar el compuesto H2. Ya que el compuesto de hidrógeno es una combinación de átomos igualados, los átomos compartirán cada uno de sus electrones individuales, formando así un enlace covalente. De esta manera, ambos átomos comparten la estabilidad de una envoltura de valencia.
Enlaces Iónicos
En los enlaces iónicos, los electrones se transfieren completamente de un átomo a otro. Durante este proceso de perder o ganar electrones cargados negativamente, los átomos que reaccionan forman iones. Lo iones cargados de manera opuesta se atraen entre ellos a través de fuerzas electroestáticas que son la base del enlace iónico.
Por ejemplo, durante la reacción del sodio con el cloro:
sodio (en la derecha) pierde su única valencia de electrones al cloro (a la derecha),
resultando en
un ión de sodio cargado positivamente (izquierda) y un ión de cloro cargado negativamente (derecha).
Una simulación de la reacción NaCl
Concept simulation - Reenacts the reaction of sodium with chlorine.
(Flash required)
Note que cuando el sodio pierde su electrón de valencia, se hace más pequeño, mientras que el cloro se hace más grande cuando gana una valencia de electrón adicional. Esto es típico de los tamaños relativos de iones a átomos. Después que la reacción tiene lugar, los iones cargado Na+ y Cl- se sujetan gracias a las fuerzas electroestáticas, formando así un enlace ionico. Los compuestos iónicos comparten muchas caractéristicas en común:
Los enlaces iónicos se forman entre metales y no metales,
Al nombrar compuestos iónicos simples, el metal siempre viene primero, el no metal segundo (por ejemplo, el cloruro de sodio),
Los compuestos iónicos se disuelven facilmente en el agua y otros solventes polares,
En una solución, los compuestos iónicos fácilmente conducen electricidad,
Los compuestos iónicos tienden a formar sólidos cristalinos con temperaturas muy altas.
Esta última característica es un resultado de las fuerzas intermoleculares (fuerzas entre las moléculas) en los sólidos iónicos. Si consideramos un cristal sólido de cloruro de sodio, el sólido está hecho de muchos iones de sodio cargados positivamente (dibujados a debajo como pequeñas esferas grises) y un número igual de iones de cloro cargados negativamente (esferas verdes). Debido a la interacción de los iones cargados, los iones de sodio y de cloro están organizados alternadamente como demuestra el esquema a la derecha. Cada ión de sodio es atraído igualmente por todos sus iones de cloro vecinos, y de la misma manera por la atracción del cloruro de sodio. El concepto de una molécula sola se vuelve borroso en cristales iónicos ya que el sólido existe como un sistema continuo. Las fuerzas entre las moléculas son comparables a las fuerzas dentro de la molécula, y los compuestos iónicos tienden a formar como resultado cristales sólidos con altos puntos de fusión.
Los siguientes compuestos presentan enlaces iónicos: NaCl (cloruro de sodio), KCl (cloruro de sodio), KI (ioduro de potasio), CaCl2 (cloruro de calcio), FeO (óxido de hierro (II)), MnO2 (manganesa), Li3N (nitruro de litio), CaC2 (acetiluro de calcio), Ca3P2 (fosfuro de calcio) y AgCl (cloruro de plata).
Los siguientes compuestos se caracerizan por poseer enlaces covalentes: H2 (gas dihidrógeno), O2 (gas oxígeno), Cl2 (gas cloro), Br2 (bromo elemental), N2 (gas nitrógeno), CH4 (metano), C2H6 (etano), S8 (azufre rómbico), P4 (fósforo blanco) y NF3 (fluoruro de nitrógeno).
luz briceño II semestre de ing. civil 003 -
El enlace covalente consiste en el compartimiento de pares de electrones por dos átomos, dando lugar a moléculas y puede ser polar o no polar.
El enlace covalente puede dar lugar a compuestos sólidos cristalinos de malla rígida tridimensional que une a cada uno de los átomos con todos los demás, en los que la totalidad del cristal es una sola molécula (p. ej., el cuarzo y el diamante), o bien a moléculas discretas que, en estado sólido, están unidas por fuerzas intermoleculares y reciben el nombre de cristales moleculares. Estos compuestos, en cualquiera de los estados de agregación, están formados por las mismas moléculas y sólo se diferencian en la ordenación de éstas.
El modelo de enlace entre iones no se puede utilizar para explicar la unión entre cualquier pareja de átomos. Si dos átomos son iguales, no existe ninguna razón que justifique que uno de estos átomos se transforme en ión. Para justificar estas situaciones se utiliza otro modelo de enlace. Cuando los átomos que forman un enlace comparten sus electrones con la finalidad de cumplir con la regla de los ocho, se forma un enlace. El tipo de enlace que se observa en la molécula de hidrógeno y en otras moléculas en que los electrones son compartidos por los dos núcleos se llama enlace covalente. En la molécula de H2 los electrones residen principalmente en el espacio entre los núcleos en donde son atraídos de manera simultánea por ambos protones. El aumento de fuerzas de atracción en esta zona provoca la formación de la molécula de H2 a partir de dos átomos de hidrógeno separados. La formación de un enlace entre los átomos de hidrógeno implica que la molécula H2O es más estable por determinada cantidad de energía, que dos átomos separados (energía de enlace).
El agua pura y la sal no conducen la electricidad, sin embargo cuando disolvemos sal en agua obtenemos una sustancia que resulta ser buena conductora de la electricidad
darlis giran I003D Ing Civil 2 semestre -
Algunas de las características de las sustancias con enlaces iónicos son:
1.- Altos puntos de fusión, relacionados con las cargas de los iones.
2.- Alta solubilidad en líquidos con elevada constante dieléctrica, como el agua.
3.- Son aislantes eléctricos en fase sólida y conductores si están fundidos.
4.-Suelen ser diamagnéticos, aunque hay excepciones si contienen metales de transición.
5.-Las propiedades ópticas del cristal pueden deducirse de la suma de las de cada uno de los iones que lo forman.
6.- Presentan baja conductividad calorífica y también baja expansión y compresibilidad térmica.
7.- Son duros, frágiles y con buena exfoliación.
8.- Pueden dar lugar a soluciones sólidas.
ENLACES COVALENTES: Se establecen entre átomos que comparten una porción de su densidad electrónica, la cual mantiene unidos a los núcleos.
Algunas de las características de las sustancias con enlaces covalentes son:
1.- Las densidades suelen ser bajas.
2.- Son aislantes o semiconductores en fase sólida y en fase fundida.
3.- Las propiedades ópticas están condicionadas por la existencia de electrones deslocalizados.
4.- Generalmente son diamagnéticos.
5.- Son insolubles en líquidos polares.
6.- Raramente forman soluciones sólidas.
Asi como se mensiona la sal
El cloruro de sodio es producido en masa por la evaporación de agua de mar o salmuera de otros recursos, como lagos salados y minando la roca de sal, llamada halita.
Migdalia Guerrero -
El enlace covalente polar es intermedio en su carácter entre un enlace covalente y un enlace iónico. Los átomos enlazados de esta forma tienen carga eléctrica neutra, por lo que el enlace se puede llamar no polar.
El enlace iónico es un tipo de interacción electrostática entre átomos que tienen una gran diferencia de electronegatividad. No hay un valor preciso que distinga la ionicidad a partir de la diferencia de electronegatividad.
NaCl, cloruro sódico, sal común. Que no es mas que la evaporación de agua de mar
Leandro Quiroz Ing. Civil I-003-D -
Los átomos enlazados de esta forma tienen carga eléctrica neutra, por lo que el enlace se puede llamar no polar.
Enlace covalente
El enlace covalente polar es intermedio en su carácter entre un enlace covalente y un enlace iónico. Los átomos enlazados de esta forma tienen carga eléctrica neutra, por lo que el enlace se puede llamar no polar.
Los enlaces covalentes pueden ser simples cuando se comparte un solo par de electrones, dobles al compartir dos pares de electrones, triples cuando comparten tres pares de electrones, o cuádruples cuando comparten cuatro pares de electrones.
Los enlaces covalentes no polares se forman entre átomos iguales, no hay variación en el número de oxidación. Los enlaces covalentes polares se forman con átomos distintos con gran diferencia de electronegatividades. La molécula es eléctricamente neutra, pero no existe simetría entre las cargas eléctricas originando la polaridad, un extremo se caracteriza por ser electropositivo y el otro electronegativo.
Enlace iónico
El enlace iónico es un tipo de interacción electrostática entre átomos que tienen una gran diferencia de electronegatividad. No hay un valor preciso que distinga la ionicidad a partir de la diferencia de electronegatividad, pero una diferencia sobre 2.0 suele ser iónica, y una diferencia menor a 1.5 suele ser covalente.en palabras mas sencillas, un enlace ionico es aquel en el que los elementos involucrados aceptan o pierden electrones (se da entre un cation y un anion) o dicho de otra forma, es aquel en el que un elemento mas electronegativo atrae a los electrones de otro menos electronegativo4 El enlace iónico implica la separación en iones positivos y negativos. Las cargas iónicas suelen estar entre -3e a +3e.
engels matos Ing. Civil I-003D IIsemestre -
Caracteristicas:
Esta formado por metal + no metal
No forma moleculas verdaderas, existe como un agregado de aniones (iones negativos) y cationes (iones positivos).
Los metales ceden electrones formando por cationes, los no metales aceptan electrones formando aniones.
Los compuestos formados pos enlaces io;nicos tienen las siguientes caracteristicas:
Son solidos a temperatura ambiente, ninguno es un liquido o un gas.
Son buenos conductores del calor y la electricidad.
Tienen altos puntos de fusion y ebullicion.
Son solubles en solventes polares como el agua
Disposicion de los iones en un cristal de cloruro de sodio
Modelo de esperas y varillas de un cristal de cloruro de sodio.
El diametro de un ion cloruro es alrededor del doble del de un ion de sodio
El cloruro de sodio es un solido cristalino de forma cubica que tiene un punto de fisiòn de 808 grados C
Enlace covalente
Caracteristicas:
Esta basado en la comparticion de electrones. Los atomos no ganan ni pierden electrones, COMPARTEN.
Esta formado por elementos no metalicos. Pueden ser 2 o 3 no metales.
Pueden estar unidos por enlaces sencillos, dobles o triples, dependiendo de los elementos que se unen.
Las caracteristicas de los compuestos unidos por enlaces covalentes son:
Los compuestos covalentes pueden presentarse en cualquier estado de la materia: solido, liquido o gaseoso.
Son malos conductores del calor y la electricidad.
Tienen punto de fusion y ebullicion relativamente bajos.
Son solubles en solventes polares como benceno, tetracloruro de carbono, etc., e insolubles en solventes polares como el agua.
jorman caraballo 21.210.415 II semestre Ing. Petroquimica -
robert chacon -
* Enlace sencillo: 2 electrones unidos fisicamente por los subniveles inferiores metricos
* Enlace doble: se comparten dos pares de electrones.
* Enlace triple: se comparten 3 pares de electrones.
* Formado el enlace covalente coordinado es idéntico a los demás enlaces covalentes.
* Se representa con una flecha " →
* Enlace cuatruple: es la union de 4 o mas atomos
CARACTERISTICAS DE LOS ENLACES IONICOS
Algunas características de los compuestos formados por este tipo de enlace son:
* Son sólidos de estructura cristalina en el sistema cúbico.
* Este enlace se produce una transferencia de electrones de un metal a un no metal formando iones
* Altos puntos de fusión y ebullición.
* Son enlaces resultantes de la interacción entre los metales de los grupos I y II y los no metales de los grupos VI y VII.
* Son solubles en solventes polares y aun así su solubilidad es muy baja.
* Una vez fundidos o en solución acuosa, sí conducen la electricidad.
* En estado sólido no conducen la electricidad. Si utilizamos un bloque de sal como parte de un circuito en lugar del cable, el circuito no funcionará. Así tampoco funcionará una bombilla si utilizamos como parte de un circuito un cubo de agua, pero si disolvemos sal en abundancia en dicho cubo, la bombilla, del extraño circuito, se encenderá . Esto se debe a que los iones disueltos de la sal son capaces de acudir al polo opuesto (a su signo) de la pila del circuito y por ello este funciona.
jesiree diaz seccion:I005D petroquimica 2 semestre -
Estos átomos tienen muchos electrones en su nivel más externo (electrones de valencia) y tienen tendencia a ganar electrones más que a cederlos, para adquirir la estabilidad de la estructura electrónica de gas noble. Por tanto, los átomos no metálicos no pueden cederse electrones entre sí para formar iones de signo opuesto.
En este caso el enlace se forma al compartir un par de electrones entre los dos átomos, uno procedente de cada átomo. El par de electrones compartido es común a los dos átomos y los mantiene unidos, de manera que ambos adquieren la estructura electrónica de gas noble. Se forman así habitualmente moléculas: pequeños grupos de átomos unidos entre sí por enlaces covalentes.
Ejemplo: El gas cloro está formado por moléculas, Cl2, en las que dos átomos de cloro se hallan unidos por un enlace covalente. En la siguiente simulación interactiva están representados 2 átomos de cloro con solo sus capas externas de electrones.
En otros casos un mismo átomo puede compartir más de un par de electrones con otros átomos. Por ejemplo en la molécula de agua (H2O) el átomo de oxígeno central comparte un par de electrones con cada uno de los dos átomos de hidrógeno. Estos pares de electrones compartidos se representan habitualmente por una barra entre los dos átomos unidos.
maria perdomo seccion: I005D ing. petroquimica 2º semestre -
En los enlaces iónicos, los electrones se transfieren completamente de un átomo a otro. Durante este proceso de perder o ganar electrones cargados negativamente, los átomos que reaccionan forman iones. Lo iones cargados de manera opuesta se atraen entre ellos a través de fuerzas electroestáticas que son la base del enlace iónico.
Los enlaces iónicos se forman entre metales y no metales,
Al nombrar compuestos iónicos simples, el metal siempre viene primero, el no metal segundo (por ejemplo, el cloruro de sodio),
Los compuestos iónicos se disuelven facilmente en el agua y otros solventes polares,
En una solución, los compuestos iónicos fácilmente conducen electricidad,
Los compuestos iónicos tienden a formar sólidos cristalinos con temperaturas muy altas.
teorileth chavez seccion:I005D petroquimica 2 semestre -
Si los átomos enlazados son no metales e idénticos (como en N2 o en O2), los electrones son compartidos por igual por los dos átomos, y el enlace se llama covalente apolar. Si los átomos son no metales pero distintos (como en el óxido nítrico, NO), los electrones son compartidos en forma desigual y el enlace se llama covalente polar polar porque la molécula tiene un polo eléctrico positivo y otro negativo, y covalente porque los átomos comparten los electrones, aunque sea en forma desigual. Estas sustancias no conducen la electricidad, ni tienen brillo, ductilidad o maleabilidad.
Cuando una molécula de una sustancia contiene átomos de metales y no metales, los electrones son atraídos con más fuerza por los no metales, que se transforman en iones con carga negativa; los metales, a su vez, se convierten en iones con carga positiva. Entonces, los iones de diferente signo se atraen electrostáticamente, formando enlaces iónicos. Las sustancias iónicas conducen la electricidad cuando están en estado líquido o en disolución acuosa, pero no en estado cristalino porque los iones individuales son demasiado grandes para moverse libremente a través del cristal.
Cuando los electrones son compartidos simétricamente, el enlace puede ser metálico o covalente apolar; si son compartidos asimétricamente, el enlace es covalente polar; la transferencia de electrones proporciona enlace iónico. Generalmente, la tendencia a una distribución desigual de los electrones entre un par de átomos aumenta cuanto más separados están en la tabla periódica.
Para la formación de iones estables y enlace covalente, la norma más común es que cada átomo consiga tener el mismo número de electrones que el elemento de los gases nobles grupo 18 más cercano a él en la tabla periódica. Los metales de los grupos 1 (o IA) y 11 (o IB) de la tabla periódica tienden a perder un electrón para formar iones con una carga positiva; los de los grupos 2 (o IIA) y 12 (o IIB) tienden a perder dos electrones para formar iones con dos cargas positivas, y de la misma forma los de los grupos 3 (o IIIB) y 13 (o IIIA) tienden a formar iones con tres cargas positivas. Por la misma razón, los halógenos, grupo 17 (o VIIA), tienden a ganar un electrón para formar iones con una carga negativa, y los elementos del grupo 16 (o VIA) a formar iones con dos cargas negativas. Sin embargo, conforme aumenta la carga neta de un ion, éste tiene menos estabilidad, así que las cargas aparentemente mayores serían minimizadas compartiendo los electrones en enlaces covalentes.
El enlace covalente se forma cuando ambos átomos carecen del número de electrones del gas noble más cercano. El átomo de cloro, por ejemplo, tiene un electrón menos que el átomo de argón (17 frente a 18). Cuando dos átomos de cloro forman un enlace covalente compartiendo dos electrones, uno de cada átomo (Cl:Cl), ambos consiguen el número 18 del argón. Es común representar un par de electrones compartido por medio de un guión entre los átomos individuales: Cl:Cl se escribe Cl-Cl.
De forma similar, el nitrógeno atómico tiene tres electrones menos que el neón (diez), pero cada nitrógeno puede conseguir el número de electrones del gas noble si comparten seis electrones: N:::N . Esto se denomina enlace triple. Análogamente, el azufre puede conseguir el número del argón compartiendo cuatro electrones en un enlace doble, S::S o S==S. En el dióxido de carbono, tanto el carbono (con sus seis electrones) como el oxígeno (con ocho) consiguen el número de electrones del neón (diez) compartiéndolos en enlaces dobles: O=C=O. En todas estas fórmulas, sólo se representan los electrones compartidos.
Nataly Buinitzky Ing. Petroquimica I-005 2do semestre -
El metal dona/cede uno o más electrones formando un ion con carga positiva o cationes, con configuración electrónica estable. Estos electrones luego ingresan en el no metal, originando un ion cargado negativamente o anión, que también tiene configuración electrónica estable. La atracción electrostática entre los iones de carga opuesta causa que se unan y formen un enlace.
Los compuestos iónicos forman redes cristalinas constituidas por iones de carga opuesta unidos por fuerzas electrostáticas. Este tipo de atracción determina las propiedades observadas. Si la atracción electrostática es fuerte, se forman sólidos cristalinos de elevado punto de fusión e insolubles en agua; si la atracción es menor, como en el caso del NaCl, el punto de fusión también es menor y, en general, son solubles en agua e insolubles en líquidos apolares como el benceno
las reacciones entre dos átomos no metales producen enlaces covalentes. Este tipo de enlace se produce cuando existe electronegatividad polar y se forma cuando la diferencia de electronegatividad no es suficientemente grande como para que se efectúe transferencia de electrones. De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular.
A diferencia de lo que pasa en un enlace iónico, en donde se produce la transferencia de electrones de un átomo a otro, en el enlace químico covalente, los electrones de enlace son compartidos por ambos átomos. En el enlace covalente, los dos átomos no metálicos comparten un electrón, es decir se unen por uno de sus electrones del último orbital, el cual depende del número atómico del átomo en cuestión
luis arvelo Ing. Petroquimica I-005 2do semestre -
Na Cl ¡ú Na + Cl-
De esta manera se forman dos iones de carga contraria: un cati¨®n (de carga positiva) y un ani¨®n (de carga negativa). La diferencia entre las cargas de los iones provoca entonces una fuerza de interacci¨®n electromagn¨¦tica entre los ¨¢tomos que los mantiene unidos. El enlace i¨®nico es la uni¨®n en la que los elementos involucrados aceptar¨¢n o perder¨¢n electrones.
En la soluci¨®n, los enlaces i¨®nicos pueden romperse y se considera entonces que los iones est¨¢n disociados. Es por eso que una soluci¨®n fisiol¨®gica de cloruro de sodio y agua se marca como "Na+ + Cl-" mientras que los cristales de cloruro de sodio se marcan "Na+Cl-" o simplemente "NaCl".
las reacciones entre dos ¨¢tomos no metales producen enlaces covalentes. Este tipo de enlace se produce cuando existe electronegatividad polar y se forma cuando la diferencia de electronegatividad no es suficientemente grande como para que se efect¨²e transferencia de electrones. De esta forma, los dos ¨¢tomos comparten uno o m¨¢s pares electr¨®nicos en un nuevo tipo de orbital, denominado orbital molecular.
A diferencia de lo que pasa en un enlace i¨®nico, en donde se produce la transferencia de electrones de un ¨¢tomo a otro, en el enlace qu¨ªmico covalente, los electrones de enlace son compartidos por ambos ¨¢tomos. En el enlace covalente, los dos ¨¢tomos no met¨¢licos comparten un electr¨®n, es decir se unen por uno de sus electrones del ¨²ltimo orbital, el cual depende del n¨²mero at¨®mico del ¨¢tomo en cuesti¨®n
JHON MONTOYA SECCION I-OO5 11 DE ING PETROQUIM -
Por ejemplo, durante la reacción del sodio con el cloro: sodio (en la izquierda) pierde su única valencia de electrones al cloro (a la derecha),
resultando en un ión de sodio cargado positivamente (izquierda) y un ión de cloro cargado negativamente (derecha).
Imágenes de Visionlearning
Características del enlace iónico. Se rompe con facilidad obteniéndose los iones que lo forman, generalmente basta disolver la substancia.
Las substancias con enlaces iónicos son solubles en solventes polares.
Cloruro de sodio disuelto en H2O
Imagen de Visionlearning
Enlaces Covalentes
El segundo tipo de enlace atómico ocurre cuando los átomos comparten electrones. Al contrario de los enlaces iónicos en los cuales ocurre una transferencia completa de electrones, el enlace covalente ocurre cuando dos (o más) elementos comparten electrones. Esto ocurre comúnmente cuando dos no metales se enlazan. Ya que ninguno de los elementos que participan en el enlace querrán ganar electrones, estos elementos compartirán electrones para poder llenar sus envolturas de valencia.
La distribución de e- compartidos y no compartidos es lo que determina la estructura tridimensional de las moléculas
Un buen ejemplo de un enlace covalente es el que ocurre entre dos átomos de hidrógeno. Los átomos de hidrógeno (H) tienen un electrón de valencia en su primera capa. Puesto que la capacidad máxima de esta capa es de dos electrones, cada átomo de hidrógeno "querrá" tomar un segundo electrón. En un esfuerzo por conseguir un segundo electrón, el átomo de hidrógeno reaccionará con átomos H vecinos para formar el compuesto H2. De esta manera, ambos átomos comparten la estabilidad de una envoltura de valencia. Lo mismo ocurre con el oxígeno, solo que tiene un enlace doble, con 2 enlaces covalentes.
Enlaces Polares y No-Polares
En realidad, hay dos sub-tipos de enlaces covalentes. La molécula H2 es un buen ejemplo del primer tipo de enlace covalente: el enlace no polar. Ya que ambos átomos en la molécula H2 tienen una igual atracción (o afinidad) hacia los electrones, los electrones que se enlazan son igualmente compartidos por los dos átomos, y se forma un enlace covalente no polar. Siempre que dos átomos del mismo elemento se enlazan, se forma un enlace no polar . Los enlaces O-O y C-H son no polares.
Los enlaces covalentes son muy fuertes y su estabilidad poco se afecta por la presencia de solventes. Un ejemplo típico de enlace covalente es el enlace Carbono-Carbono que se presenta en gran número de compuestos orgánicos.
En la práctica, los orbitales compartidos no se encuentran repartidos de manera equivalente, ya que los átomos más electronegativos tienden a mantener a los electrones en su cercanía y, por lo tanto, el orbital molecular de enlace presenta mayor volumen en la vecindad del átomo electronegativo. Los enlaces covalentes en los que ambos átomos participantes poseen una electronegatividad semejante (como en los enlaces C-C), no presentan diferencias en la carga electrónica a lo largo de la molécula, por tanto su carga eléctrica es también uniforme y se dice que no poseen polaridad.
Un enlace polar se forma cuando los electrones son desigualmente compartidos entre dos átomos, o difieren en su electronegatividad (poder del átomo en una molécula para atraer electrones). Los enlaces covalentes polares ocurren porque un átomo tiene una mayor afinidad hacia los electrones que el otro (sin embargo, no tanta como para empujar completamente los electrones y formar un ión). En un enlace polar los electrones que se enlazan pasarán un mayor tiempo alrededor del átomo que tiene la mayor afinidad hacia los electrones. Un buen ejemplo del enlace polar covalente es el enlace H-O en la molécula de agua.
Sin embargo, en muchos casos el enlace covalente se forma entre átomos de distinta electronegatividad y en consecuencia los electrones se agrupan más cerca de aquel átomo electronegativo, como consecuencia un lado de la molécula es electrodeficiente (posee carga parcial positiva) y el otro es electrodenso (posee carga parcial negativa). Este tipo de enlaces se designan como enlaces covalentes polares y las moléculas con este desbalance de cargas se designan como dipolares.
H2O: una molécula de agua
Las moléculas de agua contienen dos átomos de hidrógeno (dibujados en rojo) enlazados a un átomo de oxígeno (en azul). El oxígeno, con seis electrones de valencia, necesita dos electrones adicionales para completar su envoltura de valencia. Cada hidrógeno contiene un electrón. Por consiguiente el oxígeno comparte los electrones de dos átomos de hidrógeno para completar su propia envoltura de valencia, y en cambio, comparte dos de sus propios electrones con cada hidrógeno, completando la envoltura de valencia H.
Características del enlace covalente. Es muy fuerte y se rompe con dificultad.
Si la diferencia de electronegatividades entre los 2 átomos es marcada, tenemos un enlace polar y se favorecerá la solubilidad de la sustancia en solventes polares. Ejemplo: un enlace O-H
Si la diferencia de electronegatividad es poca, tenemos un enlace no polar y se favorecerá la solubilidad de la sustancia en solventes no polares. Ejemplo: un enlace C-H o C-C.
Puentes Hidrógeno
La presencia de cargas parciales sobre los átomos de oxígeno e hidrógeno de la molécula del agua hace posible que entre ellas mismas se formen enlaces débiles debido a la atracción electrostática, llamados puentes de hidrógeno. Dada la estructura de la molécula de agua, se pueden formar hasta 4 puentes de H, dos a través del átomo de Oxígeno y uno por cada átomo de Hidrógeno.
Son interacciones polares y su intensidad es cerca de 5-10% de enlace covalente. En el enlace por puente de hidrógeno los tipos más importantes de fuerzas de atracción son débiles y estos enlaces son los causantes de que el agua sea un líquido a temperatura ambiente en lugar de un gas. Donde existe un hidrógeno unido a un elemento fuertemente electronegativo se establece una unión intermolecular, precisamente entre el H de una molécula y el elemento fuertemente negativo de la otra.
Este enlace se puede establecer además entre el agua y cualquier otra molécula. Si el puente se establece entre dos moléculas diferentes ya sea de la misma o de diferente especie se le denomina enlace intermolecular, por ejemplo la molécula de agua, el ácido fluorhídrico etc.
Si el puente se estable entre dos elementos electronegativos de una misma molécula, el enlace se llama intramolecular, por ejemplo O- hidroxibenzaldehido, O- clorofenol etc.
jhon quevedo seccion:003 ingenieria civil -
A diferencia de lo que pasa en un enlace i¨®nico, en donde se produce la transferencia de electrones de un ¨¢tomo a otro, en el enlace qu¨ªmico covalente, los electrones de enlace son compartidos por ambos ¨¢tomos. En el enlace covalente, los dos ¨¢tomos no met¨¢licos comparten un electr¨®n, es decir se unen por uno de sus electrones del ¨²ltimo orbital, el cual depende del n¨²mero at¨®mico del ¨¢tomo en cuesti¨®n.
Caracter¨ªsticas del enlace covalente
Enlace sencillo: 2 electrones unidos fisicamente por los subniveles inferiores metricos
Enlace doble: se comparten dos pares de electrones.
Enlace triple: se comparten 3 pares de electrones.
Formado el enlace covalente coordinado es id¨¦ntico a los dem¨¢s enlaces covalentes.
Se representa con una flecha " ¡ú
Enlace cuatruple: es la union de 4 o mas atomos
jhon quevedo -
A diferencia de lo que pasa en un enlace i¨®nico, en donde se produce la transferencia de electrones de un ¨¢tomo a otro, en el enlace qu¨ªmico covalente, los electrones de enlace son compartidos por ambos ¨¢tomos. En el enlace covalente, los dos ¨¢tomos no met¨¢licos comparten un electr¨®n, es decir se unen por uno de sus electrones del ¨²ltimo orbital, el cual depende del n¨²mero at¨®mico del ¨¢tomo en cuesti¨®n.
Caracter¨ªsticas del enlace covalente
Enlace sencillo: 2 electrones unidos fisicamente por los subniveles inferiores metricos
Enlace doble: se comparten dos pares de electrones.
Enlace triple: se comparten 3 pares de electrones.
Formado el enlace covalente coordinado es id¨¦ntico a los dem¨¢s enlaces covalentes.
Se representa con una flecha " ¡ú
Enlace cuatruple: es la union de 4 o mas atomos
mayra roa -
LA QUIMICA GENERAL:
ESTUDIA LAS LEYES FUNDAMENTALES QUE SE RELACIONAN CON LA SUSTANCIAS Y SUS TRANSFORMACIONES DE LA MATERIA.
LA QUIMICA ES LA BASE DE MI CARRERA ES MUY INDISPENSABLE SU CONOCIMIENTO YA QUE POR MEDIO DE EL SE DESARROLLARA GRAN PARTE DE LOS MECANISMOS Y ESTRATEGIAS A UTILIZAR EN LAS LABORES QUE SEAN ASIGNADAS EN ALGUNA EMPRESA.
ALUMNA: MAYRA ROA
SECCION: 005
CARRERA ING PETROQUIMICA