Actividades Prácticas sobre la Entropía...
Buenos Días!!!
Disculpen la tardanza de esta semana, se me complicó un poco debido al cierre del segundo corte en el otro instituto…
El próximo lunes conversaremos sobre la recuperación de la clase perdida por el feriado del 5 de Julio…
Para continuar con el tema de conversación, como es la “Segunda Ley de la Termodinámica”, hoy les quiero plantear un conjunto de páginas o recursos donde podremos encontrar diversos ejercicios relacionados a la entropía, uno de estas páginas es http://www2.udec.cl/~dfiguero/curso/termodos/termodos.html, donde, además de ciertas reflexiones relacionadas a las leyes de la termodinámica, encontraremos algunos ejercicios propuestos; otra página es http://joule.qfa.uam.es/beta-2.0/temario/tema2/tema2.php, de la Universidad Autónoma de Madrid, donde encontraremos algunas animaciones y videos, además de una hoja de ejercicios y un acceso a una presentación en PowerPoint, que sugiero observar… Otro recurso está en la dirección http://www.google.co.ve/url?sa=t&source=web&cd=5&ved=0CCMQFjAE&url=http%3A%2F%2Fs3.amazonaws.com%2Flcp%2Fclasegeo%2Fmyfiles%2Fproblemas-de-ENTROPIA.doc&ei=cTA3TPuwNMH68Aau0LWyAw&usg=AFQjCNFvvGpau_WSsYVVevywSBQFzUNR0g (disculpen lo extenso…), donde encontraremos unos ejercicios sobre la segunda ley, largamente explicados y bien interesantes, y en http://www.juliweb.es/fisica/ejercicios/problemastermodinamica.pdf encontraremos algunos ejercicios para resolver que permitirán completar la información…
Les recuerdo la sugerencia de entrar a http://www.profesorenlinea.cl/Ciencias/entropia.htm, página bien didáctica y a http://www.youtube.com/watch?v=veFLTN13PGo (El video, véanlo y lo conversaremos este lunes…, no hagan trampa…J).
La actividad para esta semana corresponderá al análisis de las siguientes preguntas, para cada sección:
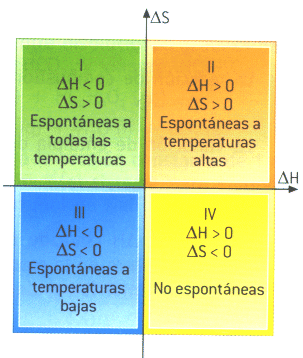
Sección 001) La variación de entalpía = 0, para una reacción exotérmica en un sistema cerrado con trabajo P-V solamente, bajo condiciones isobáricas y adiabáticas, ¿verdadero o falso?¿por qué?
Sección 003) Una sustancia en un estado termodinámico normal debe estar a 25ºC, ¿cierto o falso?¿por qué?
Recuerden colocar nombre y sección…
Saludos!!!
39 comentarios
Rhusbel Martin -
rhusbel martin -
Victor Ruiz -
arraiz rosani seccion i001 petroleo -
mirian aguirre 003 petroleo -
ya que existe en el estado termodinámico refrigerante, vapores, por lo tanto no tiene un estado termodinámico normal
gabriela garcia -
Gabriela garcia
seccion: 003
Henyoli Arias -
Henyoli Arias
C.I 19.891.791
I-003-D
ELINA AGUILAR... Ing. Petrñoleo 003 -
EBERT LUIS RODRIGUEZ-I-003-D -
EBERT LUIS RODRIGUEZ PIMENTEL
C.I. 21.404.891.
ING DE PETRÓLEO
SECCION I-003-D
Erick Quintana Seccion I-001D -
Yolimar Goyo seccion I-001D -
La relación entre la energía transferida en forma de calor por el sistema y la variación de entropía del entorno a presión constante. Es decir la variación de entropía del entorno es igual al calor perdido por el sistema. Según el segundo principio de la termodinámica si un proceso es espontaneo se produce un aumento de la entropía total del sistema y los alrededores. Bajo condiciones isobaras la reacción es negativo y la entropía es mayor que 0.
Goyo yolimar
Sección 001
Anónimo -
Diana Herrera
C.I: 18627056
Seccion:I-D-003
Jahemdy Medina -
C.I: 18852862
Ing. Petroleo 003-D
TEJERA LUISABEL -
Con respecto ala pregunta es falso; ya que el estado estandar o normal de una sustancia es en el cual esta se muestra pura, este debe estudiar las distintas variaciones de sus propiedades asi como la energia interna, el ambiente, entre otros.
Tejera Luisabel
CI V- 20.11.448
Ing. P "003"
Crister Hurtado -
Ing. Petróleo Sección 003
PAOLA ARROYO CI 18613771 -
SECCION 001
ING PETROLEO
jarek -
Garcia Milagros. C.I. 18.858.778 -
ING. PETROLEO.I001
Lopez Lisaid. C.I.20.247.398.ING.Petroleo.I001. -
La variación permite expresar la cantidad de calor puesto en juego durante una transformación isobárica es decir, a presión constante en un sistema termodinámico teniendo en cuenta que todo objeto conocido puede ser entendido como un sistema termodinámico, transformación en el curso de la cual se puede recibir o aportar energía por ejemplo la utilizada para un trabajo mecánico. En este sentido la entalpía es numéricamente igual al calor intercambiado con el ambiente exterior al sistema en cuestión.
Por esta razón es falso que le entalpia es igual a 0 . En una reacción exotérmica a presión constante, la variación de entalpía del sistema es igual a la energía liberada en la reacción, incluyendo la energía conservada por el sistema.
isabel portillo -
Es falso ya que este expresa una medida de la cantidad de energía absorbida o cedida por un sistema termodinámico variación corresponde a la capacidad calorífica del sistema a presión constante.
Adriana Valles -
V SEMETRE
ING. PETROLEO
Si la 2da ley nos dice que la entropia debe ser constante o aumentar, y ademas si recordamos lo que nuestro querido profe dice en clase, pues entonces, podemos concluir que sin variacion de calor no hay entropia dentro de un sistema ciclico, por lo tanto es falsa, pero creo que esta planteada la pregunta de una forma extraña( o dicho con palabras del profe, una concha de mango), puesto que 1ro nos dice que es exotermica(libera calor) y luego q es adiabatica(no entra ni sale calor).
Frank Hernandez -
Con respecto a la interrogante, pienso que es falso debido a que cuando existe una reaccion exotermica el sistema debe desprender energia por lo que la variacion de entalpia deberia ser negativa, y si la entalpia es negativa no podemos estar en presencia de un sistema adiabatico.
Frank Hernandez.
C.I:21454004.
Seccion:001-D.
Ender Vargas -
jeniree pirela -
es totalmente falso, por que cuando la reaccion es exotermica la variacion de entalpia del sistema es negativo y por lo tanto no puede ser igual a cero.
jeniree pirela
ci:19772578
petroleo 001
Maria Ysabel Solorzano Peña -
Si la sustancia es un gas a esa presión y temperatura, el estado estándar se elige como aquel en el que el gas se comporta como gas ideal. En el caso de disoluciones líquidas ideales (o disoluciones sólidas ideales) el estado estándar de cada componente se elige como el líquido (o el sólido puro) a la T y P de la disolución (o a P=1bar, realmente hay poca diferencia si la presión no es muy alta). En el caso de disoluciones diluidas ideales el estado estándar del disolvente se elige como el líquido (o el sólido puro) a la T y P de la disolución, sin embargo el estado estándar del soluto es un estado ficticio a la T y P de la disolución, que resulta de extrapolar las propiedades del soluto en las disoluciones muy diluidas al caso límite en el que su fracción molar fuera 1.
Maria Ysabell Solorzano
C.I.:19.523.358
Seccion 003 de petroleo 5to Semestre
aiker quijada -
aiker quijada
20981547
001
petroleo
Francisco Parra -
Francisco Parra
C.I: 20.152.115
Sección 001 D
Ing Petróleo
Nadwa Carvajal -
ing. de petroleo
Nadwa Carvajal
profe aqui esta mi asistencia yo creo que el estado estándar o normal de una sustancia, es la forma pura más estable de la misma, a la presión de 1 bar y a la temperatura especificada cualquiera que esa sustancia cumpla para su condicion ideal. Si la sustancia es un gas a esa presión y temperatura, el estado estándar se elige como aquel en el que el gas se comporta como gas ideal.
LEONARDO ROMERO -
es totalmente falso porque en una reaccion exotermica la cual desprende energia , es decir con una variacion negativa de entalpia por lo tanto jamas va hacer 0 ... gracias
ROMERO LEONARDO
SECCION 001-D
ING. PETROLEO ....
YUMELIN RODRIGUEZ -
es falso ya que se debe seguir ciertas condiciones, y debido a las condiciones del contorno puede llegar a tener un equilibrio termodinamico.
yumelin rodriguez ci:20163561 seccion;003
Wendy Mirena -
C.I 19927671
seccion 001 petroleo
Eso es falso ya que la variación de la entalpia para la reacción exotérmica a una presión constante será igual a la energía liberada en la reacción, incluyendo la energía conservada por el sistema y otra que se pierde a través de la expansión, es decir que cuando la reacción es exotérmica la variación de entalpía del sistema es negativa y por lo tanto no puede ser igual a cero ya que la variación de entalpía de un proceso es directamente proporcional a la cantidad de sustancia que se produce en la reacción.
Yesibeth Gil -
Bachiller: Yesibeth Gil
C.I: 18.431.324
Sección: 003-D
HUGO BRICEÑO -
HUGO BRICEÑO
C.I: 19.107.870
SECCION:003-D
MAIRA ADAMES -
PETROLEO 003
MARYELIN ROJAS SECCION 001 -
MAYORQUIN MARLIEM C.I.: 20.091.279 -
CON RESPECTO A LA PREGUNTA:
Es falsa ya que cuuando es una reaccion exotermica con presion constante, la variacion de la entalpia es negativa por lo tanto no es igual a cero.
Nancys Sanchez -
C.I:19991964
ING PETROLEO
SECCION 001
5TO SEMESTRE
hola profesor muy buenas noches!!!! con respecto a la pregunta,, es totalmente falso ya que Para una reacción exotérmica a presión constante, la variación de entalpía del sistema es igual a la energía liberada en la reacción, incluyendo la energía conservada por el sistema y la que se pierde a través de la expansión contra el entorno. esto quiere decir que cuando la reaccion la variacion de entalpia del sistema es negativa por lo tanto no es igual a cero (0).
Maria Lugo Seccion 003 -
Estado estándar o normal : El estado estándar de una sustancia, es la forma pura más estable de la misma, a la presión de 1 bar y a la temperatura especificada. Si la sustancia es un gas a esa presión y temperatura, el estado estándar se elige como aquel en el que el gas se comporta como gas ideal. En el caso de disoluciones líquidas ideales (o disoluciones sólidas ideales) el estado estándar de cada componente se elige como el líquido (o el sólido puro) a la T y P de la disolución (o a P=1bar, realmente hay poca diferencia si la presión no es muy alta). En el caso de disoluciones diluidas ideales el estado estándar del disolvente se elige como el líquido (o el sólido puro) a la T y P de la disolución, sin embargo el estado estándar del soluto es un estado ficticio a la T y P de la disolución, que resulta de extrapolar las propiedades del soluto en las disoluciones muy diluidas al caso límite en el que su fracción molar fuera 1. En el caso de disoluciones no ideales hay dos convenios diferentes, uno supone elegir el estado estándar de las disoluciones ideales, y el otro el de las disoluciones diluidas ideales, (el convenio ha de especificarse, porque en cualquier caso debe cumplirse que , lo que implica un valor diferente de μi0, de ai y de γi).
Para cada valor de temperatura existe un único estado normal de una sustancia pura dada, dicho estado se representa por y se lee entalpía molar estándar a la temperatura T.
Arbitrariamente la entalpía molar de cada elemento a la presión de 1bar y temperatura de 25ºC es tomado como cero. Existen elementos como es el caso del carbono que tienen varias formas alotrópicas, el diamante y el grafito. Para tales elementos, se toma como sustancia de referencia la forma estable a 25ºC y 1 bar. En este caso la forma más estable es el grafito, y su entalpía es cero, pero no es cero la del diamante. Este convenio arbitrario se aplica a elementos no a compuestos, excepción hecha de los gases diatómicos homonucleares.
Enelis Burgos -
C.I.: 20118337
secc. I-003-D
falso: Para que un proceso termodinamico sea normal se deben cumplir ciertas condiciones, ya que esta estuudia los cambios de energia o la cantidad de energia que intercambia con su entorno. Para que se cumpla un proceso termodinamico debe haber cuerpos con diferentes temperaturas.