Información fresca y volátil!!!
Buenas tardes!!!
Les tengo información definitivamente fresca acerca de los proyectos de vinculación, tan fresca que estoy saliendo de la reunión de Ciclo Básico directo a traérselas:
- Se deben estar presentando entre Lunes 08 y Martes 09 de Febrero, en su turno correspondiente, por lo cual el tercer parcial deberá ser adelantado al Jueves 04 (Civil) y Viernes 05 (Petroquímica).
- Todos deben desarrollar vinculación con las materias que cursan, por lo que aquellos seres de Dios que no cursan la materia "líder" de la vinculación (003: Física I; 005: Álgebra Lineal), igualito deben desarrollar el informe que les pedí... cómo? Reflejando en su informe las actividades que sus compañeros que sí cursan estas materias desarrollaron.
Recuerden, para el día de la presentación del proyecto, deben entregarme el informe!!!
Esta semana les estoy colocando en el espacio público que tengo en MSN (http://cid-f5e16d6b27fde625.skydrive.live.com/browse.aspx/P%C3%BAblico/Semestre%202-2009%20%5E5Qu%C3%ADmica%20General%5E6?uc=2&lc=22538) un archivo Word 2007 donde he resumido algunos aspectos correspondientes a las propiedades físicas y químicas de las soluciones: Ley de Raoult, propiedades coligativas y algunos ejercicios que pueden interesarle...
Su opinión, esta semana, estará orientada a comentar sobre ¿qué propiedad coligativa se pone en evidencia cuando usamos alguna solución? por supuesto, con algún ejemplo que tome de su vida cotidiana...
Saludos!!!
21 comentarios
jose rosales 2do semestre de petroquimica seccion i005 -
milianyer landaeta -
jhon quevedo -
en nuesta vida cotidiana cuando ppeparamos alguna bebida instantanea se ve la concentracion del suluto.
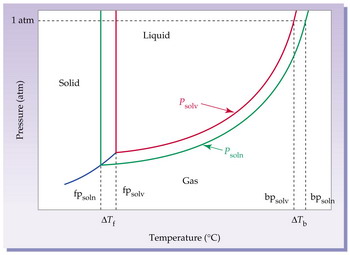
La presión de vapor depende del solvente y de la temperatura a la cual sea medida.
vidal jose Ing petroquimica -
vidal jose ING petroquimica -
Yulay Acosta -
seccion I.005
Ing petroquimica
En química, se llaman propiedades coligativas aquellas propiedades de una solución que dependen únicamente de la concentración molal, es decir, de la cantidad de partículas de soluto por partículas totales, y no de la naturaleza o tipo de soluto. Están estrechamente relacionadas con la presión de vapor, que es la presión que ejerce la fase de vapor sobre la fase líquida, cuando el líquido se encuentra en un recipiente cerrado.Por ejemplo, el agua se congela a partir de los 0 °C, mientras que una solución formada por agua y sal se congelará a menor temperatura (de ahí que se utilice sal para fundir nieve o hielo con mayor facilidad).
Ana Julia Da Silva Ci. 20.760.108 -
Nataly Biunitzky C.I. 21.327.393 I005 Petroquimica -
Luis Arvelo C,I. 22.414.117 -
Dayana Oliveros c.i. 20.663.015 I005 Petroquimica -
willard bravo 18937662 ptroquimica 005 -
jesiree diaz 20194534 ng petroqumica 005 -
maria perdomo seccion: I005D ing. petroquimica 2º semestre -
el líquido refrigerante de los motores de los automóviles tiene una base de agua pura a presión atmosférica se congelaría a 0°C dentro de las tuberías y no resultaría útil en lugares fríos. Para evitarlo se le agregan ciertas sustancias químicas que hacen descender su punto de congelación.
teorileth chavez C.I:21097130 seccion:I005D petroquimica II semestre -
A presión externa de 1 atm, el agua hierve a 100 °C, mientras que para una solución acuosa de algo a 100 °C las presiones externas y de vapor no se han igualado y por ende no se observa el cambio a estado gaseoso. Cuando la presión de vapor iguale la presión externa la temperatura de la solución será mayor que 100 °C y, consecuentemente, se comprueba que su punto de ebullición es, efectivamente, mayor que el punto de ebullición de su solvente puro (agua) medido a una misma presión externa.
raigelys querales C.I:19525349 ing petroquimica seccion 005 -
Cuando usamos desodorantes en aerosol, estas usando una propiedad coligativa, ya que el sudor seria una solucion de sodio y potasio.Ahi hay una desviacion de las que se dicen de "Rauolt".
jonatahn quiñones C.I: 19479058 seccion 005 petroquimica -
un ejemplo serian los refrigerantes de motor de autmovil ( aumento del punto ebulloscopico y descenso del crioscopico).
norgelis campos C.I:19772161 ing petroquimica 005 -
Cuando tenemos las manos mucho tiempo en agua, se arrugan las yemas de los dedos, pues sale el agua de las celulas de la piel, pues la concentracion de agua es mayor fuera ( presion osmotica).
ana gallardo ci:20247628. 2do semestre ingenieria petroquimica -
JHON MONTOYA SECCION I-005-D 2DO SEMESTRE ING. PETROQUIMICA 19.479.445 -
Propiedades coligativas más comunes:
■Descenso de la Presión de Vapor
Cuando se prepara una solución con un solvente ¨puro¨ y un soluto NO VOLÁTIL (que no se transformará en gas -vapor-) y se mide su Presión de vapor, al compararla con la Presión de vapor de su solvente puro, se observa que la presión de vapor de la solución es MENOR que la presión de vapor del solvente. Esto es consecuencia de la presencia del soluto no volátil. A su vez, cuando compara las presiones de vapor de dos soluciones de igual composición y diferente concentración, veremos que aquella solución más concentrada tiene menor Presión de vapor.
Descenso de Pvapor = Pvapor solvente - Pvapor solución
como ejemplo cotidiano podemos decir que el agua de playa se encuentra en un desenso crioscopico ya que la sal es un factor el cual permite su enfriamiento y en caso del oceano artico un compacto de hielo con agua pura de salmuera ya que las particulas de sal se encuentran en suspencion.
Ing. Petroquimica I005D Pereira Joel 21.199.697 -
Jorman Caraballo 21.021.415 Ing. Petroquimica -