Un análisis más extenso de la Entropía...
Buenas Tardes!!!
Disculpen la tardanza de esta semana, se me complicó un poco debido a las actividades causadas por el primer mes de fallecimiento de mi hijastra…
Para continuar con el tema de conversación, como es la “Segunda Ley de la Termodinámica”, hoy les quiero plantear un conjunto de páginas o recursos donde podremos encontrar diversos ejercicios relacionados a la entropía, uno de estas páginas es http://www2.udec.cl/~dfiguero/curso/termodos/termodos.html, donde, además de ciertas reflexiones relacionadas a las leyes de la termodinámica, encontraremos algunos ejercicios propuestos; otra página es http://joule.qfa.uam.es/beta-2.0/temario/tema2/tema2.php, de la Universidad Autónoma de Madrid, donde encontraremos algunas animaciones y videos, además de una hoja de ejercicios y un acceso a una presentación en PowerPoint, que sugiero observar… Otro recurso está en la dirección http://www.google.co.ve/url?sa=t&source=web&cd=5&ved=0CCMQFjAE&url=http%3A%2F%2Fs3.amazonaws.com%2Flcp%2Fclasegeo%2Fmyfiles%2Fproblemas-de-ENTROPIA.doc&ei=cTA3TPuwNMH68Aau0LWyAw&usg=AFQjCNFvvGpau_WSsYVVevywSBQFzUNR0g (disculpen lo extenso…), donde encontraremos unos ejercicios sobre la segunda ley, largamente explicados y bien interesantes, y en http://www.juliweb.es/fisica/ejercicios/problemastermodinamica.pdf encontraremos algunos ejercicios para resolver que permitirán completar la información…
Les recuerdo la sugerencia de entrar a http://www.profesorenlinea.cl/Ciencias/entropia.htm, página bien didáctica y a http://www.youtube.com/watch?v=veFLTN13PGo (El video, véanlo y lo conversaremos este lunes…, no hagan trampa…J).
La actividad para esta semana corresponderá al análisis de las siguientes preguntas, para cada sección:
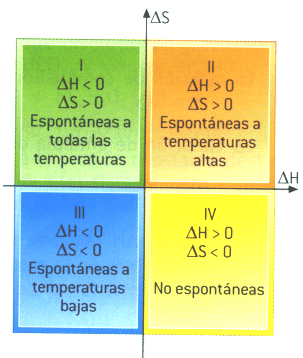
Sección 001) La variación de entalpía = 0, para una reacción exotérmica en un sistema cerrado con trabajo P-V solamente, bajo condiciones isobáricas y adiabáticas, ¿verdadero o falso?¿por qué?
Sección 003) Una sustancia en un estado termodinámico normal debe estar a 25ºC, ¿cierto o falso?¿por qué?
Recuerden colocar nombre y sección…
Saludos!!!
49 comentarios
wilkin moreno -
SECCION:I003D
ES CIERTO... signando un valor cero a ciertos estados de referencia. En el caso de elementos y
compuestos el estado normal o de referencia es de nuevo su forma física más estable a la presión de
una atmósfera y a una temperatura constante de 25ºC.
jesus valera -
SECCION:I003D
SI ES CIERTO... signando un valor cero a ciertos estados de referencia. En el caso de elementos y
compuestos el estado normal o de referencia es de nuevo su forma física más estable a la presión de
una atmósfera y a una temperatura constante de 25ºC.
roimar perez 003 -
normal debe estar a 25ºC, ¿cierto o falso?¿por qué?
si es cierto..
asignando un valor cero a ciertos estados de referencia. En el caso de elementos y
compuestos el estado normal o de referencia es de nuevo su forma física más estable a la presión de
una atmósfera y a una temperatura constante de 25ºC.
isidro martinez c.i 18957588 seccion 003 -
Es cierto porque esta es la forma pura mas estable de dicha sustancia es decir es un estado estandar en el cual su entalpia es cero.
Anthony Ylarraza -
CI. 20697165
Ing Petroleo
Seccion I003
Una sustancia en un estado termodinámico normal debe estar a 25ºC, ¿cierto o falso?¿por que?
Es Cierto.
Porque?
el estado de una sustancia se elige arbitrariamente como el estado normal o estándar de la sustancia a 25ºC y presion 1 bar
Alejandra Rivas -
Sección: I-001-D.
Carrera: Ing de Petróleo.
Semestre: IV
La variación de entalpía = 0, para una reacción exotérmica en un sistema cerrado con trabajo P-V solamente, bajo condiciones isobáricas y adiabáticas, ¿verdadero o falso?¿por qué?
Cuando tenemos una reacción exotérmica en un sistema cerrado en condiciones isobáricas y adiabáticas, la entalpía si es igual a cero porque la presión no varía y no hay transferencia de calor.
MONTERO ANA 003 -
johana castillo -
es falso porque la estolpia es la cantidad de energía de un sistema termodinámico que éste puede intercambiar con su entorno, y es menor que cero....
JULIA AVILA -
20.180.757
PETROLEO I-001
IV SEMESTRE
PODIAMOS DECIR QUE ES FALSO YA QUE LA ENTALPIA ES LA VARIACION PARA UNA REACCION EXOTERMICA EN UN SISTEMA CERRADO CON TRABAJO SOLAMENTE, YA QUE ESTAS REACCIONES EXOTERMICAS TIENDEN A PRESENTAR DISTINTAS VARIACIONES EN SU MAYORIA EN LA ENTALPIA....
Edgar Quintero -
C.I:18.433.606
Seccion:I003-D
Es cierto...porque el estado estándar o normal de una sustancia, es la forma pura más estable de la misma, a la presión de 1 bar y a la temperatura de 25 ºC es tomado como cero.
Yisel Zarate -
C.I:18.433.890
Seccion:I003-D
Es cierto...ya que sus propiedades intensivas y se toma arbitrariamente o como referencia el estado normal o estándar de la sustancia a 25ºC y 1bar respectivamente
Arevalo Yosbraulys -
Arévalo Yosbraulys Seccion: 001
Arevalo Yosbraulys -
Es falso, porque si la reacción endotérmica se realiza en un sistema de paredes adiabáticas, como consecuencia de la reacción se produce una disminución en la temperatura del sistema. Si la reacción es exotérmica y se realiza en un recipiente de paredes adiabáticas, la temperatura final del sistema aumenta. Ya que para una reacción exotérmica es: (Q0).
Arévalo Yosbraulys
Seccion: 001 IV Semestre
Ing. Petróleo
Arevalo Yosbraulys -
Es falso, porque si la reacción endotérmica se realiza en un sistema de paredes adiabáticas, como consecuencia de la reacción se produce una disminución en la temperatura del sistema. Si la reacción es exotérmica y se realiza en un recipiente de paredes adiabáticas, la temperatura final del sistema aumenta. Ya que para una reacción exotérmica es: (Q0).
Arévalo Yosbraulys
Seccion: 001 IV Semestre
Ing. Petróleo
Angulo Johana -
Seccion:003
Una sustancia en un estado termodinámico normal debe estar a 25ºC, ¿cierto o falso?¿por qué?
Es cierto, porque cualquier sustancia termodinamica en su estado normal puede presentar las condiciones adecuadas para tener o estar en dicha temperatura
Victor Ruiz -
C.I. 20083597
I-001D ing Petroleo IV Semestre
La variación de entalpía = 0, para una reacción exotérmica en un sistema cerrado con trabajo P-V solamente, bajo condiciones isobáricas y adiabáticas, ¿verdadero o falso?¿por qué?
Es verdadero por que siendo un sistema cerrado, adiabático e isobarico las diferencia de entalpías es igual a = 0 tomando en cuanta las características particulares de este ejemplo, es decir, donde la presión no varía y no existe transferencia de calor se podría decir que la variación de entalpía es = 0
sequera dayli -
Por que la entalpía en condiciones isobáricas y adiabáticas desprende energía del sistema y como ya sabemos toda energía que se desprende del sistema es negativo. Lo que quiere decir que la entalpía es menor a cero.
Dayli Sequera
seccion:I-001
Euclides Rojas -
Si es verdadero que El estado convencional de una sustancia se elige arbitrariamente como el estado normal o estándar de la sustancia a 25ºC y 1bar.
Mluisa Ruiz -
C.I 20.486.110
Seccion I003-D
Ing de petróleo
Una sustancia en un estado termodinámico normal debe estar a 25ºC, ¿cierto o falso?¿por qué?
Es cierto, porque el estado estándar o normal de una sustancia, es la forma pura más estable de la misma, a la presión de 1 bar y a la temperatura de 25 ºC.
Yolimar Bustamante. -
C.I: 16400427
Seccion I-001-D
La variación de entalpía = 0, para una reacción exotérmica en un sistema cerrado con trabajo P-V solamente, bajo condiciones isobáricas y adiabáticas, ¿verdadero o falso? ¿Por qué?
Las reacciones exotérmicas bajo condiciones isobáricas, tienden a presentar distintas variaciones en su mayoría en la entalpia cuya reacción es desprender energía a su entorno, por lo que presenta una variación negativa (-) en su entalpia y esta es menor a cero
caicedo katherine 21215113 001-D. -
por lo tanto es verdadero .
Caicedo Katherine
21215113
001-D
Ing. petroleo
Jorge Alcazar -
jorge alcazar
20513800
seccion I-001-D
PETROLEO
yusmelis torres -
yusmelis tores
c.i: 21457972
La variación de entalpía = 0, para una reacción exotérmica en un sistema cerrado con trabajo P-V solamente, bajo condiciones isobáricas y adiabáticas, ¿verdadero o falso?¿por qué?
como sabemos la entalpia, en pocas palabras, es la cantidad de energía que un sistema puede intercambiar con su entorno.
en este ejemplo tenemos una reaccion exotermica, donde nos dice que la variacion de entalpia es = 0, esto es falso, ya que en una reccion como esta a presion constante es negativa la variación de entalpía.
Es decir que cuando la reacción es exotérmica la variación de entalpía del sistema es negativa.
khaled al hassan -
I-003
Una sustancia en un estado termodinámico normal debe estar a 25ºC, ¿cierto o falso?¿por que?
es cierto, ya que, el estado convencional de una sustancia se elige arbitrariamente como el estado normal o estándar de la sustancia a 25ºC
Dianny Vera -
Seccion- I-003
En general, los valores tabulados de entalpías, se refieren a los valores asignados a las sustancias químicas en sus estados convencionales. El estado convencional de una sustancia se elige arbitrariamente como el estado normal o estándar de la sustancia a 25ºC y 1bar.
Arbitrariamente la entalpía molar de cada elemento a la presión de 1bar y temperatura de 25ºC es tomado como cero. Existen elementos como es el caso del carbono que tienen varias formas alotrópicas, el diamante y el grafito. Para tales elementos, se toma como sustancia de referencia la forma estable a 25ºC y 1 bar. En este caso la forma más estable es el grafito, y su entalpía es cero, pero no es cero la del diamante. Este convenio arbitrario se aplica a elementos no a compuestos, excepción hecha de los gases diatómicos homonucleares.
franci albornoz -
relaciones se puede comprobar experimentalmente, y con eso la de los principios de la temperatura
Andres Castillo. Seccion 003 de petroleo -
Sección 003
Una sustancia en un estado termodinámico normal debe estar a 25ºC, ¿cierto o falso?¿por qué?
Es cierto; Ya que en general, los valores tabulados de entalpías, se refieren a los valores asignados a las sustancias químicas en sus estados convencionales. El estado convencional de una sustancia se elige arbitrariamente como el estado normal o estándar de la sustancia a 25ºC y 1bar.
El estado estándar de una sustancia, es la forma pura más estable de la misma, a la presión de 1 bar y a la temperatura especificada. Si la sustancia es un gas a esa presión y temperatura, el estado estándar se elige como aquel en el que el gas se comporta como gas ideal.
YULBI GUEDEZ -
Ci. 21.477.659
001 de Ing. Petroleo
Considero que es falso ya que las reaccion exotermica a una presion constante es negativo por lo tanto es menor que cero
Carlos Molina -
Una sustancia en un estado termodinámico normal debe estar a 25ºC, ¿cierto o falso?¿por qué?
Es cierto porque esta es la forma pura mas estable de dicha sustancia es decir es un estado estandar en el cual su entalpia es cero.
anabel pineda -
I003D Ing petroleo
es cierto ya que los valores tabulados de entalpías, se refieren a los valores asignados a las sustancias termodinamicas en sus estados convencionales. El estado convencional de una sustancia se elige arbitrariamente como el estado normal o estándar de la sustancia a 25ºC y 1bar.
diaz daniela petroleo i001 -
jose eloy marquez seccion 003 c.i 18855652 4 semestre de petroleo -
flores miguel c.i 19059329 seccion 003 de petroleo -
isidro martinez c.i 18957588 seccion 003 -
jose eloy marquez seccion 003 c.i 18855652 4 semestre de petroleo -
normal debe estar a 25ºC, ¿cierto o falso?¿por qué?cierto ya que nos permite analizar la viabilidad del uso de una sustancia para actividades determinadas, debido a que indica la probabilidad de que la misma se volatilice.
jose eloy marquez seccion 003 c.i 18855652 4 semestre de petroleo -
El índice de peligrosidad (Ip) de una sustancia está determinado por el cociente entre la presión de vapor de la sustancia y su CMP (concentración máxima permitida) en condiciones estándar (25 ºC y 1 atm), por lo que Sección 003) Una sustancia en un estado termodinámico normal debe estar a 25ºC, ¿cierto o falso?¿por qué? es sierto ya que nos permite analizar la viabilidad del uso de una sustancia para actividades determinadas, debido a que indica la probabilidad de que la misma se volatilice.
arraiz rosani -
QUINTERO DIANA -
C.I 20090465
SECCION:003
Una sustancia en un estado termodinámico
normal debe estar a 25ºC, ¿cierto o falso?¿por qué?
es cierto, ya que el estado estándar de una sustancia, es la forma pura más estable de la misma, a la presión de 1 bar y a la temperatura especificada. Si la sustancia es un gas a esa presión y temperatura, el estado estándar se elige como aquel en el que el gas se comporta como gas ideal. En el caso de disoluciones líquidas ideales (o disoluciones sólidas ideales) el estado estándar de cada componente se elige como el líquido (o el sólido puro) a la T y P de la disolución (o a P=1bar, realmente hay poca diferencia si la presión no es muy alta). En el caso de disoluciones diluidas ideales el estado estándar del disolvente se elige como el líquido (o el sólido puro) a la T y P de la disolución, sin embargo el estado estándar del soluto es un estado ficticio a la T y P de la disolución, que resulta de extrapolar las propiedades del soluto en las disoluciones muy diluidas al caso límite en el que su fracción molar fuera 1. En el caso de disoluciones no ideales hay dos convenios diferentes, uno supone elegir el estado estándar de las disoluciones ideales, y el otro el de las disoluciones diluidas ideales, (el convenio ha de especificarse, porque en cualquier caso debe cumplirse que , lo que implica un valor diferente de μi0, de ai y de γi).
jorge zambrano -
la respuesta a esta pregunta es falso ..
ya que para la entalpia la consideramos como : h
jorge zambrano i001ing petro.. -
la respuesta a esta pregunta es falso ..
ya que para la entalpia la consideramos como : h
yonnathan chirinos -
C.I: 20.293.192
Seccion: I-003
Ing Petròleo
Una sustancia en un estado termodinámico
normal debe estar a 25ºC, ¿cierto o falso?¿por qué?
Es verdaderamente Cierto
El estado convencional de una sustancia se elige arbitrariamente como el estado normal o estándar de la sustancia a 25ºC y 1bar.
Existen elementos como es el caso del carbono que tienen varias formas alotrópicas, el diamante y el grafito. Para tales elementos, se toma como sustancia de referencia la forma estable a 25ºC y 1 bar. En este caso la forma más estable es el grafito, y su entalpía es cero, pero no es cero la del diamante. Este convenio arbitrario se aplica a elementos no a compuestos, excepción hecha de los gases diatómicos homonucleares.
dennis flores -
C.I 20255364
Ing. Petroleo
Seccion. I003
Una sustancia en un estado termodinámico
normal debe estar a 25ºC, ¿cierto o falso?¿por qué?
si es cierto..
asignando un valor cero a ciertos estados de referencia. En el caso de elementos y
compuestos el estado normal o de referencia es de nuevo su forma física más estable a la presión de
una atmósfera y a una temperatura constante de 25ºC.
RONIE CARMONA -
C.I:17.889.881
I003 ING. PETROLEO
DIURNO.
Es cierto.
Ya que es necesario contar con datos de temperatura, presión, estado de agregación y características de ese estado de agregación es fácil imaginarse la dificultad para comparar entalpías.
yohaisi galeano -
20663715
ING. PETROLEO
SECCION: I-003-D
Una sustancia en un estado termodinámico normal debe estar a 25ºC, ¿cierto o falso?¿por que?
cierto.Arbitrariamente la entalpía molar de cada elemento a la presión de 1bar y temperatura de 25ºC es tomado como cero.
Anamin Cario -
seccion I-001
es falso, la variación de entalpia para reacciones exotermicas en condiciones isobaricas, es decir, a presion constante, es negativa ya que en estas reacciones se desprende enrgia. es decir es menor que cero (0)
Jose G Lovera seccion 003 -
19.641.094
seccion 003
Una sustancia en un estado termodinámico normal debe estar a 25ºC, ¿cierto o falso?¿por que?
Respuesta
es cierto?
porque el estado termodinamico normal implica que la temperatura de 25ºC es tomado como cero, y la presion de cada elemento es de un 1bar
yuscely tovar -
es decir en una reacion exotermica se desprende energia, y esta se da por una variacion negativa de entalpia.
en conclusion la variacion de entalpia es < 0
tovar yuscely
seccion I001
wilson yovera seccion 003 -
es cierto!!! pero el estado convencional de las sustancias termodinamicas se determina a traves de sus propiedades intensivas y se toma arbitrariamente o como referencia el estado normal o estándar de la sustancia a 25ºC y 1bar respectivamente.
wilson yovera seccion 003 -
es cierto...!!! pero el estado convencional de una sustancia se elige a traves de sus propiedades intensivas y se toma arbitrariamente o como referencia el estado normal o estándar de la sustancia a 25ºC y 1bar. respectivamente